2026-01-26
临影医药
概述:放射性药物的战略地位与监管框架
放射性药物是指含有放射性核素、用于人体疾病诊断或治疗的制剂。根据用途,可分为诊断用放射性药物(如PET/CT、SPECT显像剂)和治疗用放射性药物(如核素靶向治疗药物)。其发展水平直接关系到肿瘤、心脑血管、神经退行性疾病等重大疾病的早期发现、精准分型和有效治疗。
我国对放射性药物实行严格的监管,其注册申请需经过CDE的技术审评。CDE的受理情况,尤其是逐年变化的品种、数量与结构,是洞察行业创新能力、技术风向和市场潜力的“晴雨表”。分析2019-2025年的数据,可以清晰地看到中国放射性药物正从跟随模仿走向并行引领,从单一诊断走向“诊疗一体化”,从个别品种突破走向平台化、多元化发展的全新阶段。
从诊断为主到诊疗一体,治疗成为新引擎
发展轨迹清晰地从依赖18 F核素诊断,转向以177 Lu为代表的治疗性核素驱动。诊疗一体化(Theranostics)模式成为研发范式和商业逻辑的核心。
核素多元化与平台化开发
使用的放射性核素从单一的18 F迅速扩展到68 Ga、177 Lu、64 Cu、89 Zr、223 Ra、90 Y、125 I、131 I等十余种,覆盖PET诊断、SPECT诊断、β治疗、α治疗、介入治疗、粒子植入等所有技术路径。企业倾向于围绕一个热门靶点(如PSMA),用不同核素进行“套装”开发,构建产品矩 靶点创新与适应症拓展:早期以代谢显像(FDG)为主,现在已全面转向靶向特异性显像和治疗。前列腺癌(PSMA)、神经内分泌肿瘤(SSTR)、成纤维细胞激活蛋白(FAPI)相关肿瘤等成为最热门的适应症领域,并不断向其他实体瘤、乃至非肿瘤疾病(如神经疾病、心血管疾病)拓展。
政策与产业生态协同优化
CDE对放射性药物的审评审批速度加快,并出台了相关技术指导原则,鼓励创新。同时,国内放射性同位素生产供应、药物自动化合成模块、第三方医学影像中心、核医学病房等产业链各环节都在快速完善,为行业爆发提供了基础支撑。
竞争国际化与创新源头化
国内申报的许多品种与全球研发热点高度同步,甚至出现“并跑”态势。越来越多的本土企业开始布局原创靶点探针和国际前沿核素(如α核素、64 Cu等),创新源头能力逐步增强。
面临的挑战与未来展望
下附2019年至2025年CDE受理的放射性药物列表
2019年CDE受理的放射性药物
18 F类药物
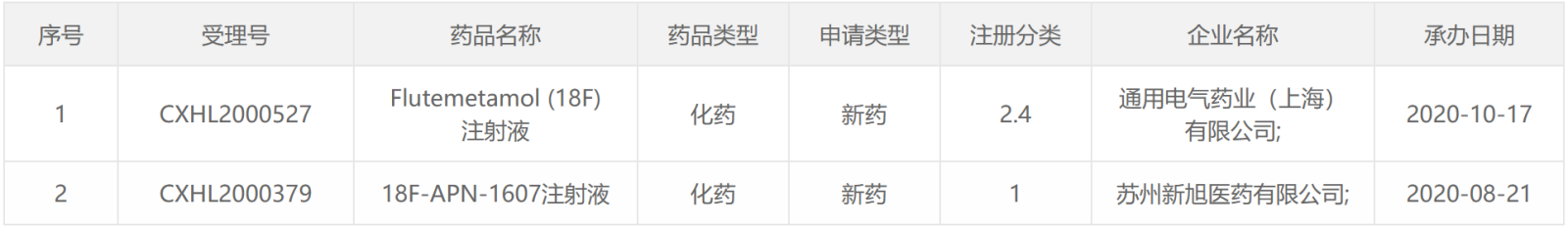
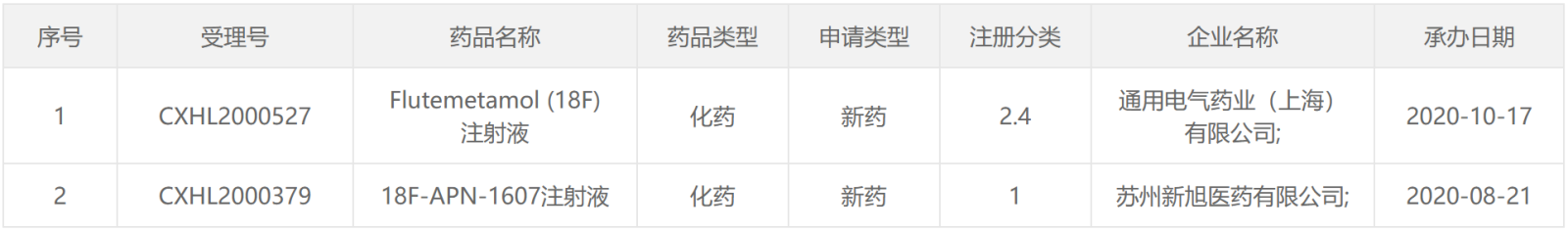
2020年CDE受理的放射性药物
18 F类药物

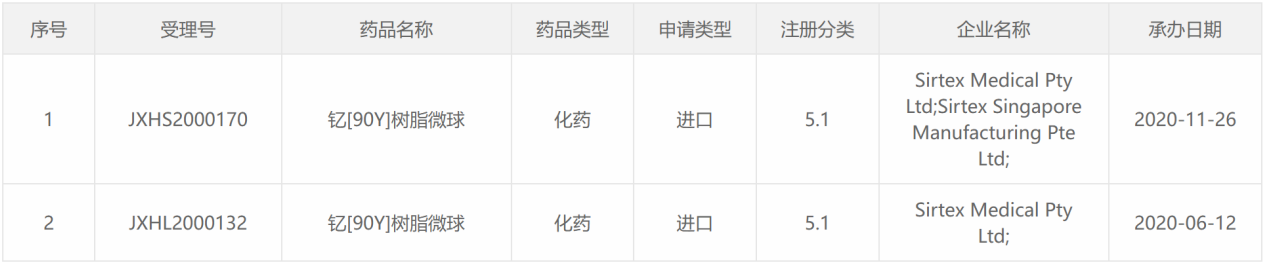
90 Y类药物
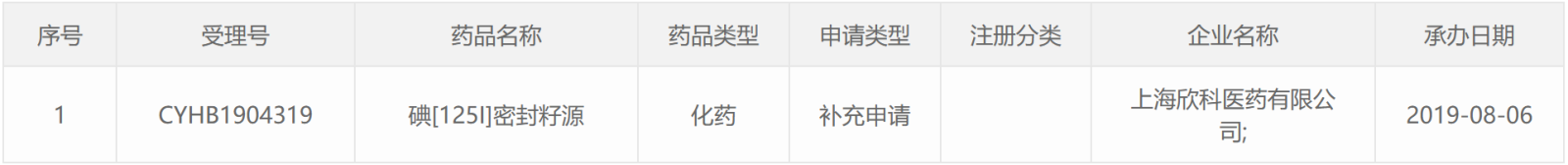
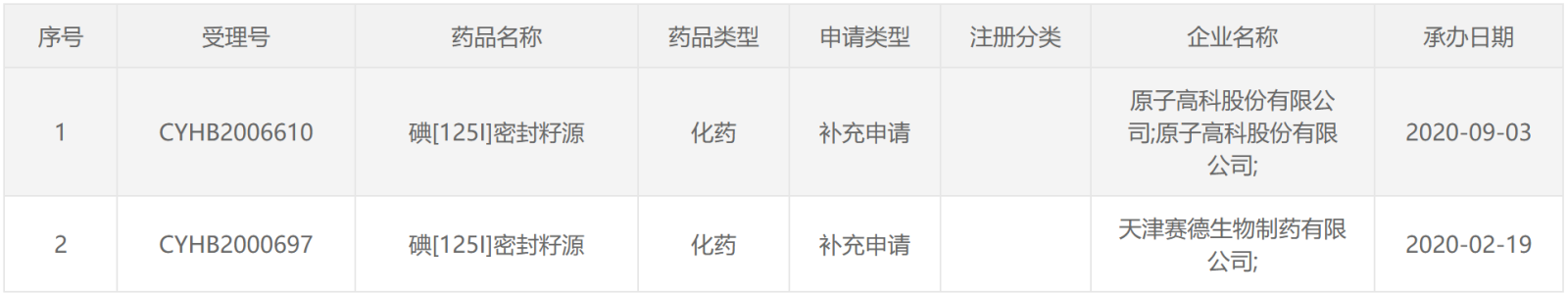
125 I类药物
177 Lu类药物

2021年CDE受理的核药
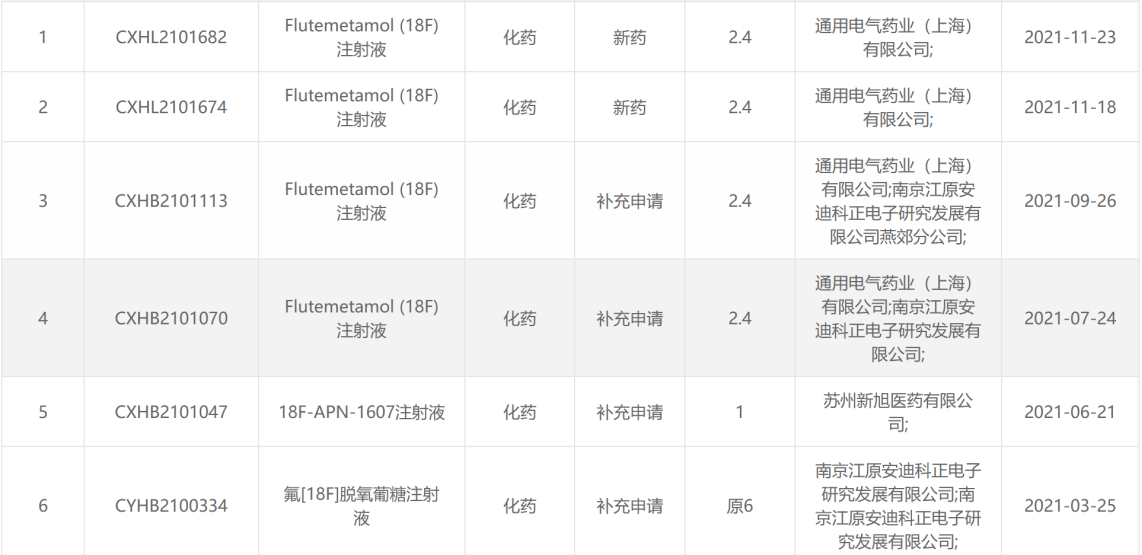
18 F类药物
68 Ga类药物

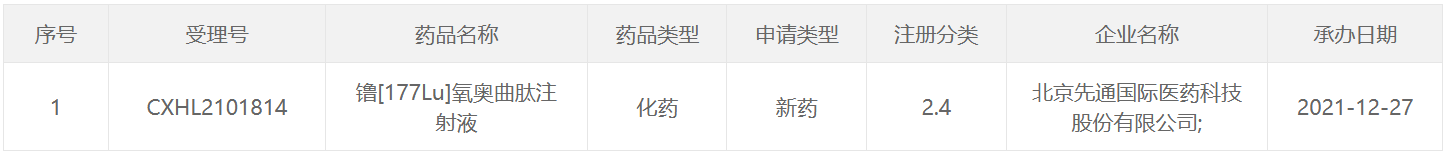
177 Lu类药物
233 Ra类药物

125 I类药物
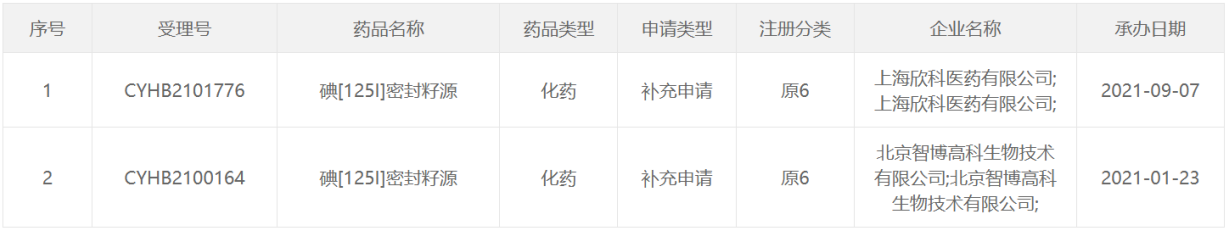
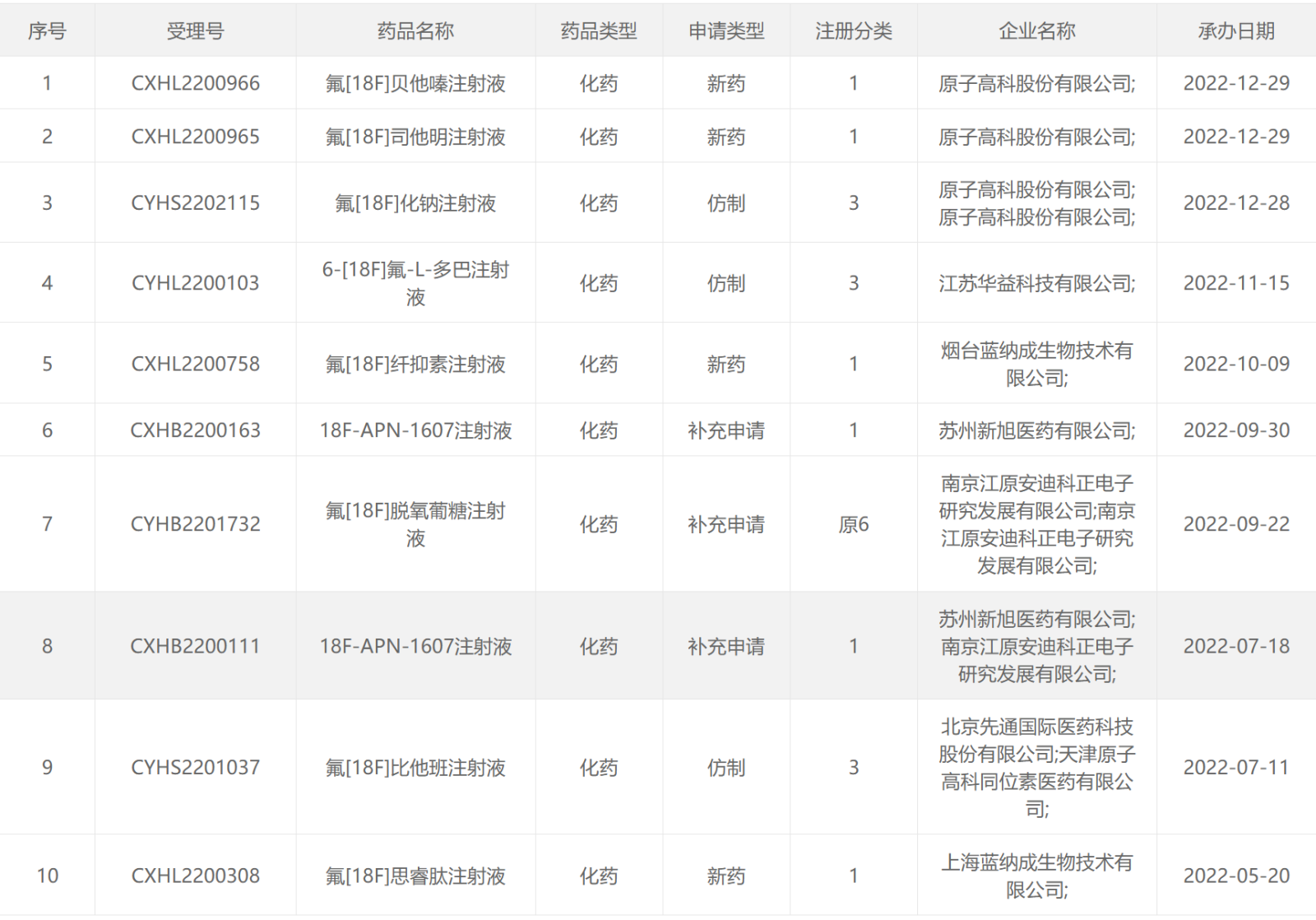
2022年CDE受理的核药
18 F类药物
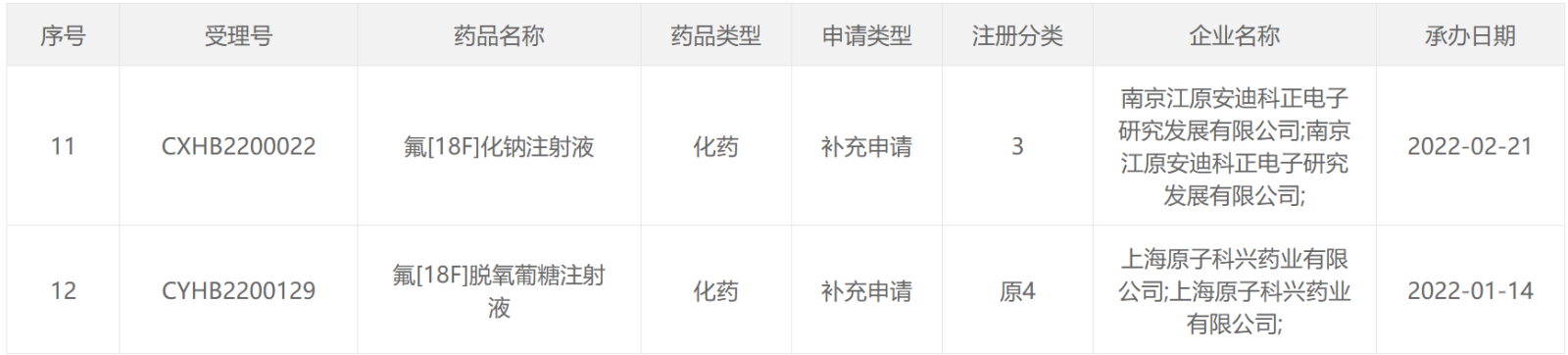
68 Ga类药物
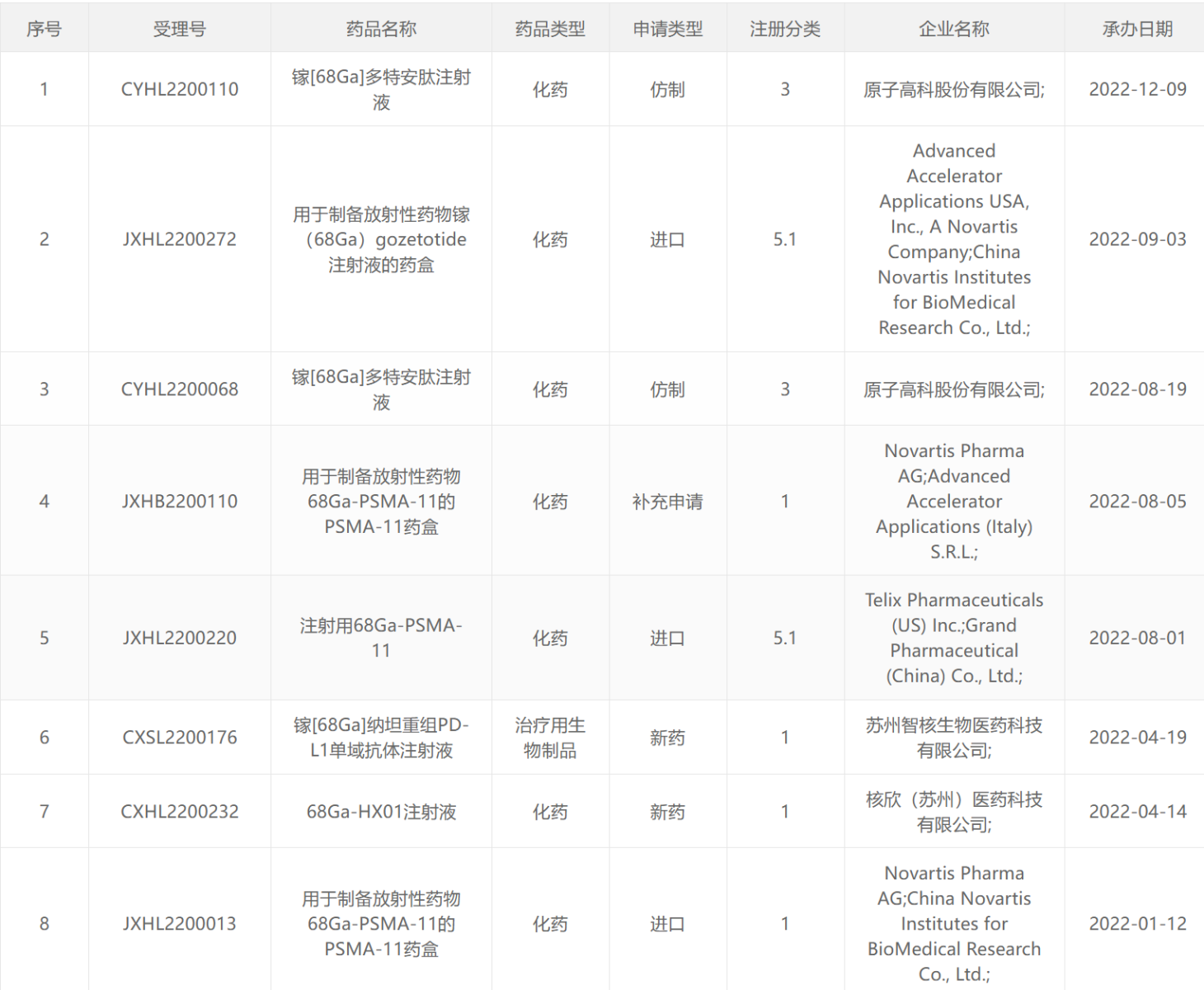
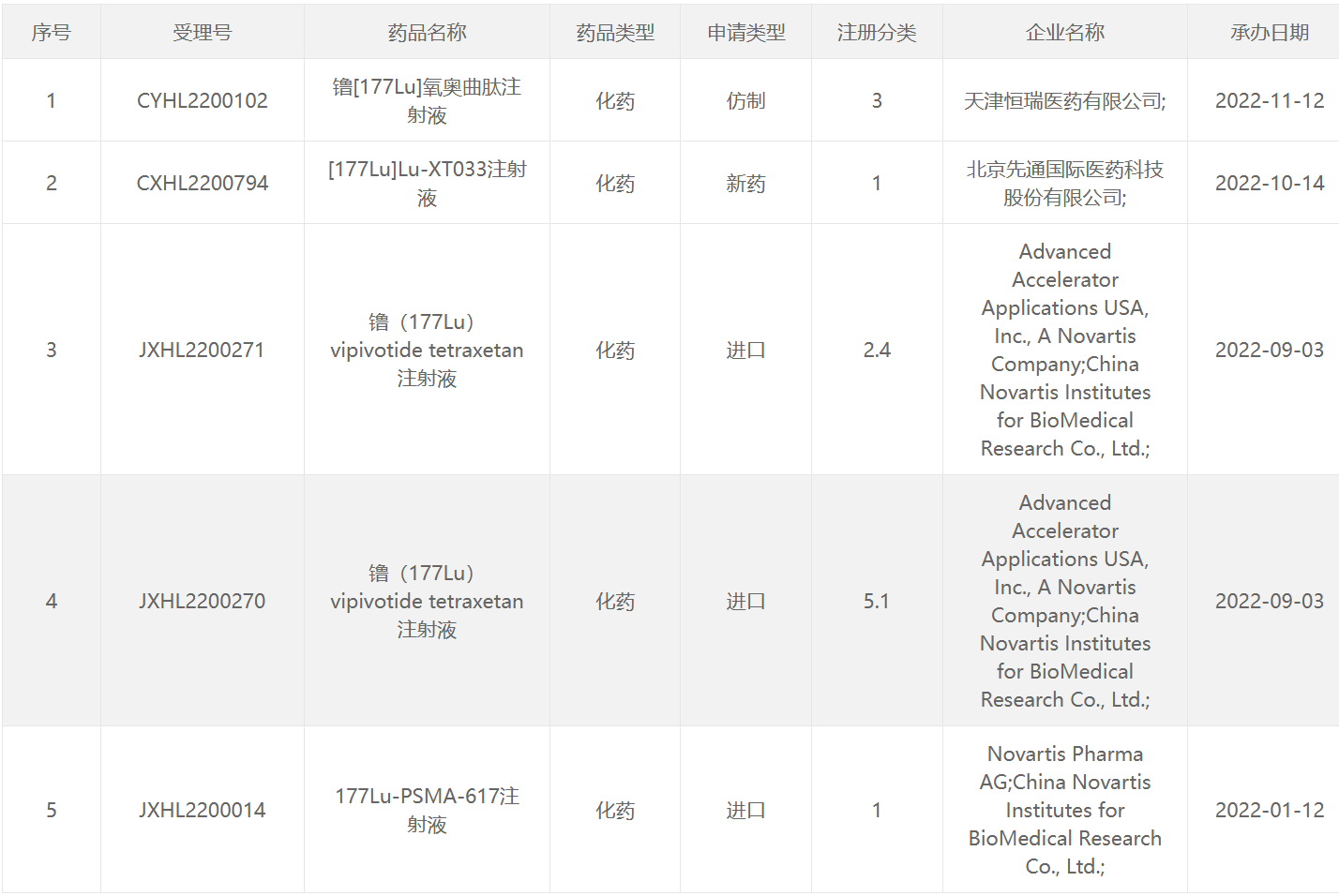
177 Lu类药物
89 Zr类药物

233 Ra类药物

125 I类药物

2023年CDE受理的放射性药物
18 F类药物
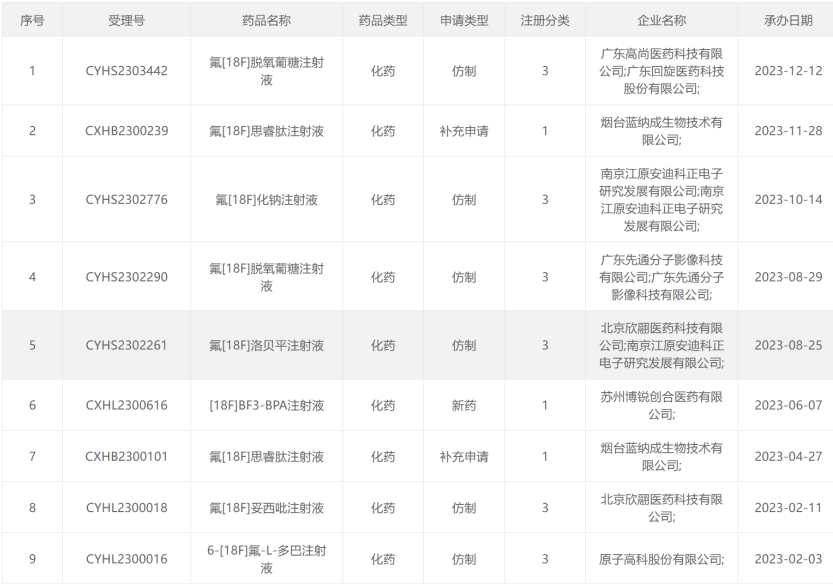
68 Ga类药物
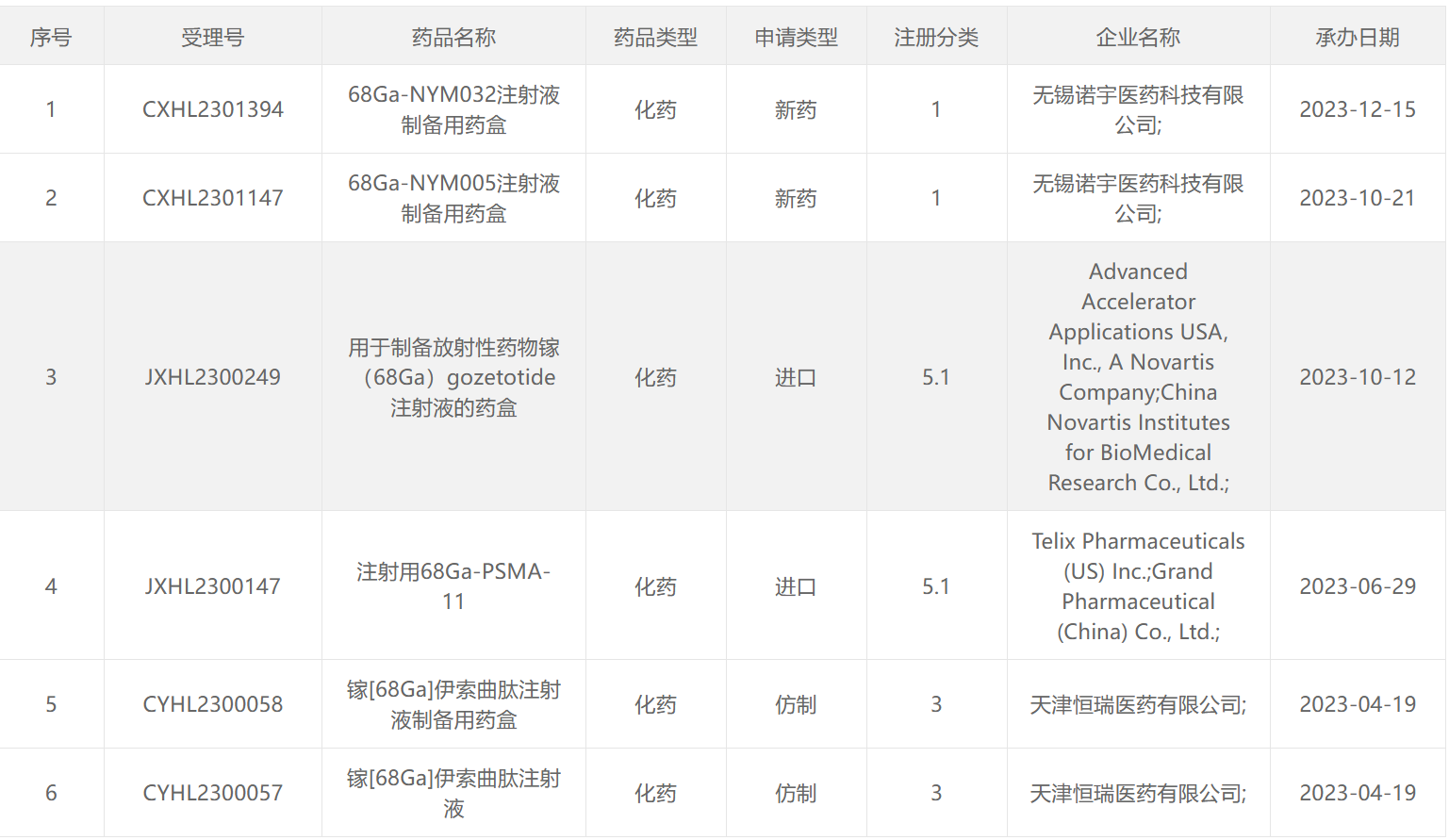
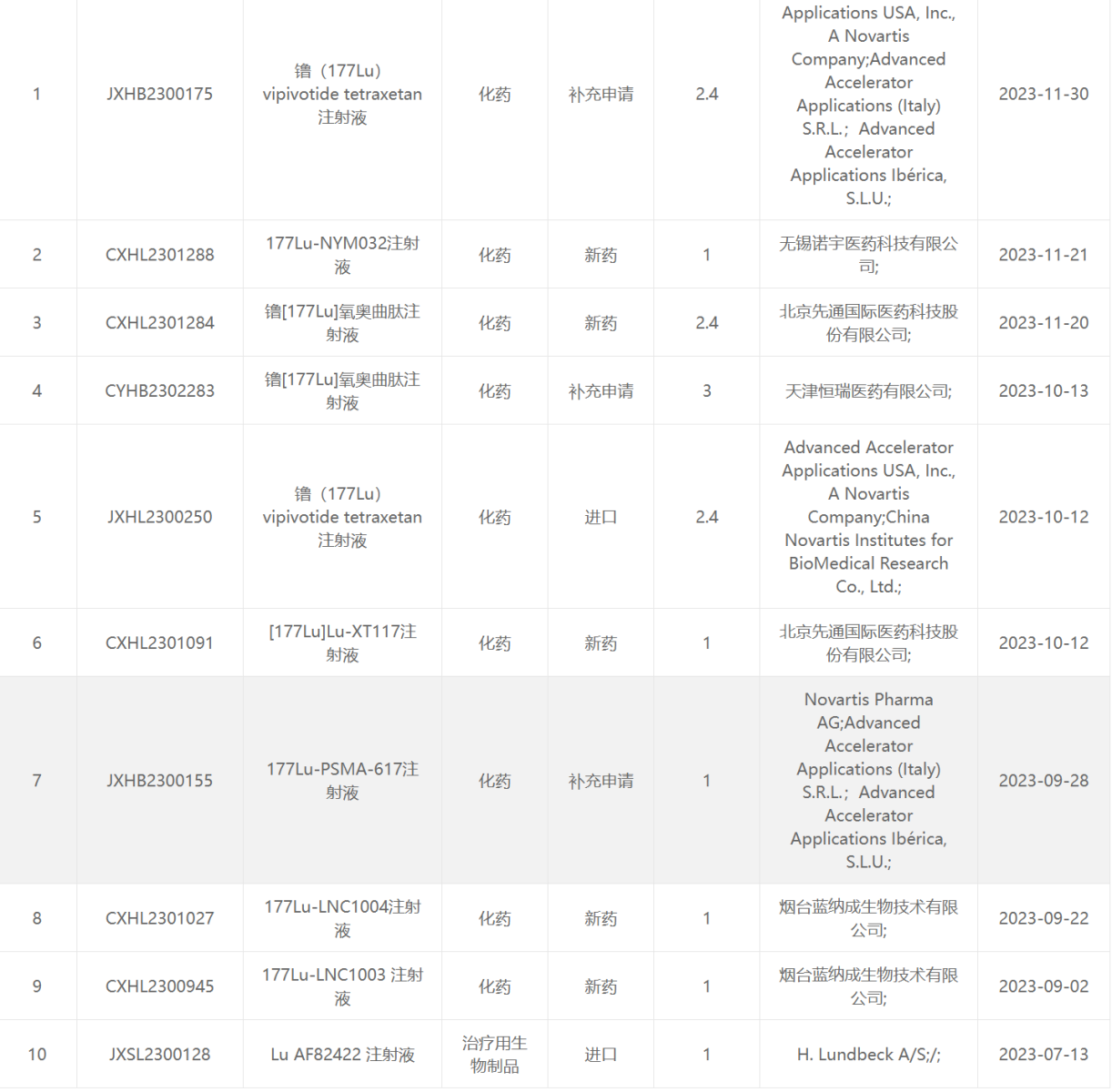
177 Lu类药物
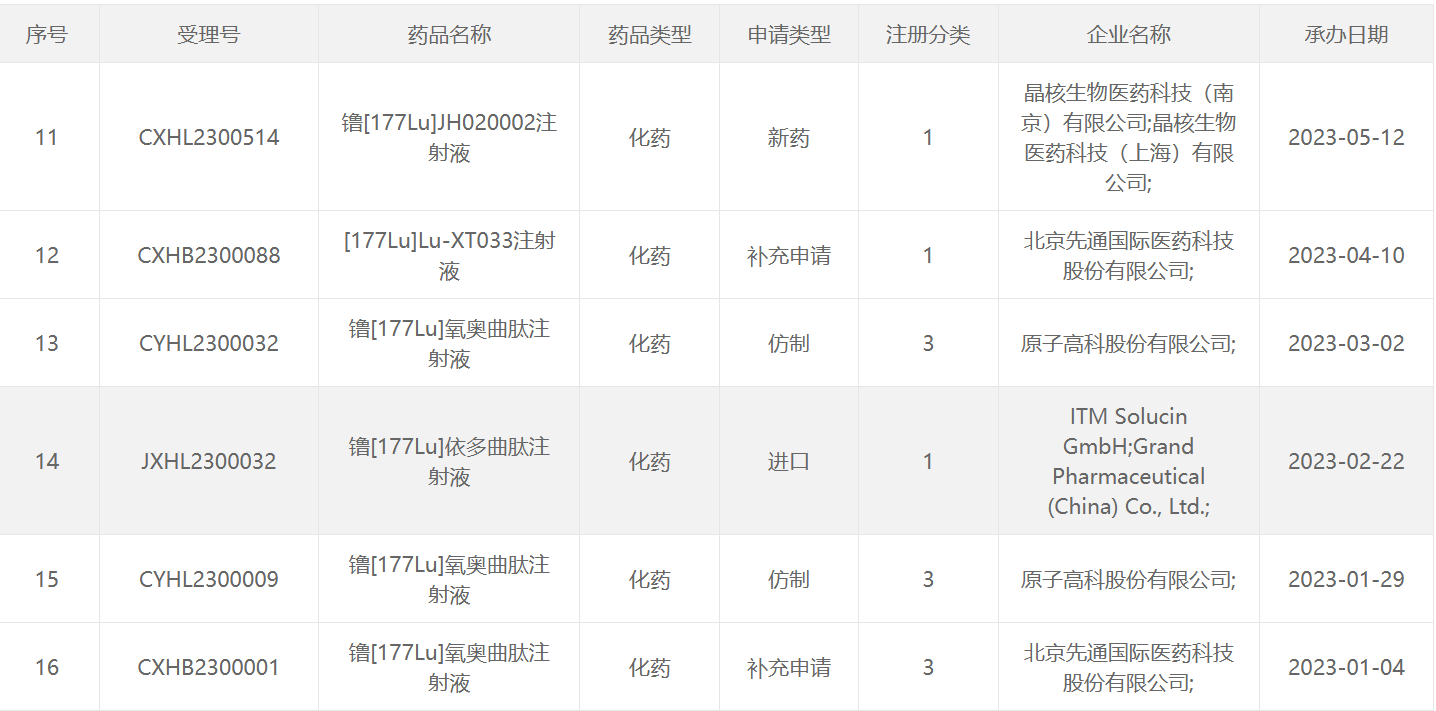
131 I类药物

2024年CDE受理的放射性药物
18 F类药物
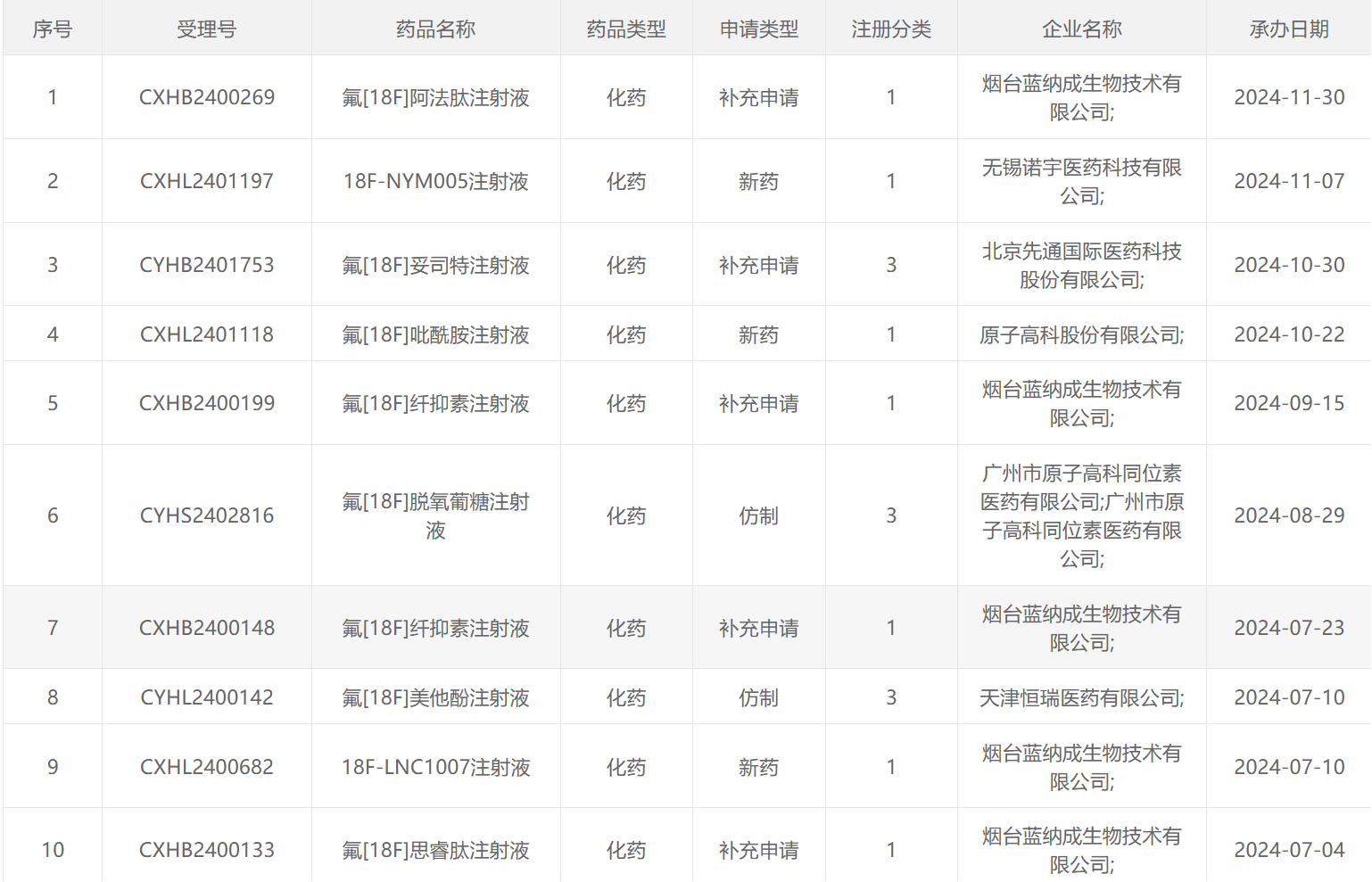
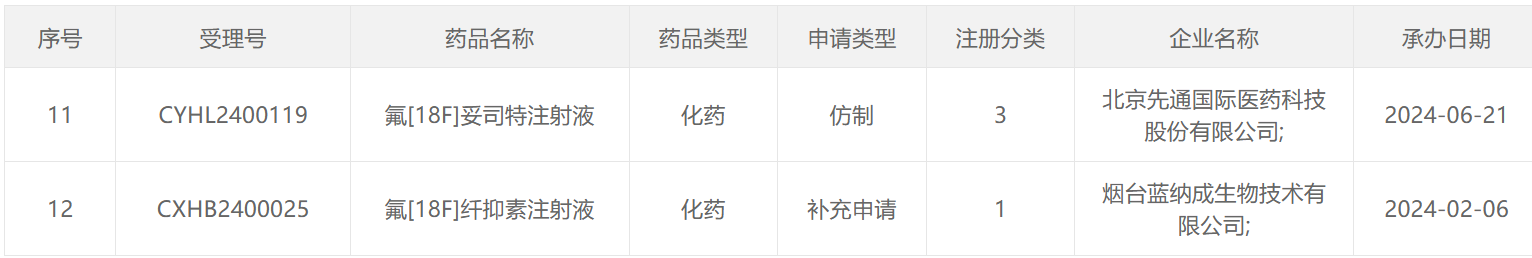
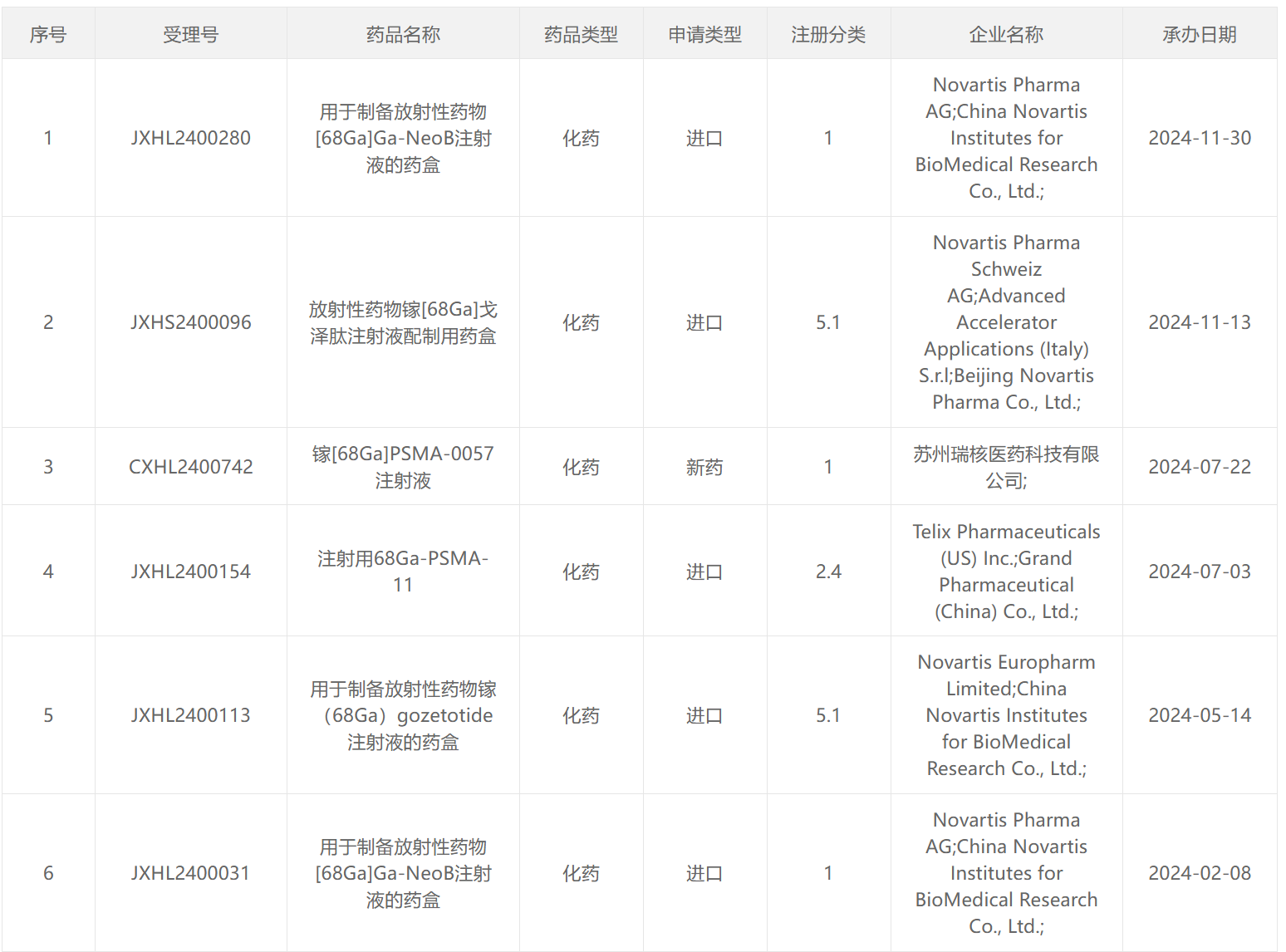
68 Ga类药物
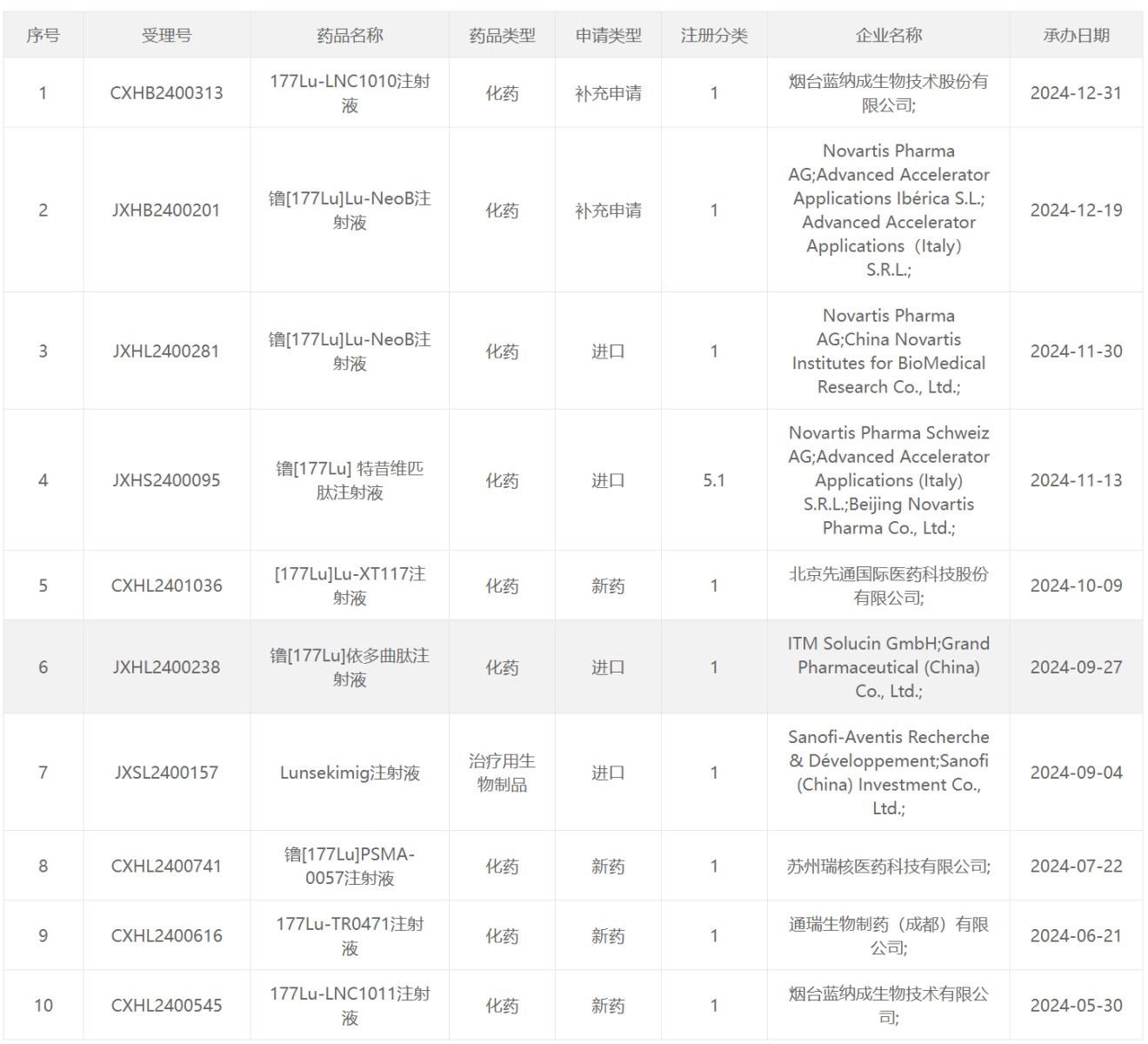
177 Lu类药物
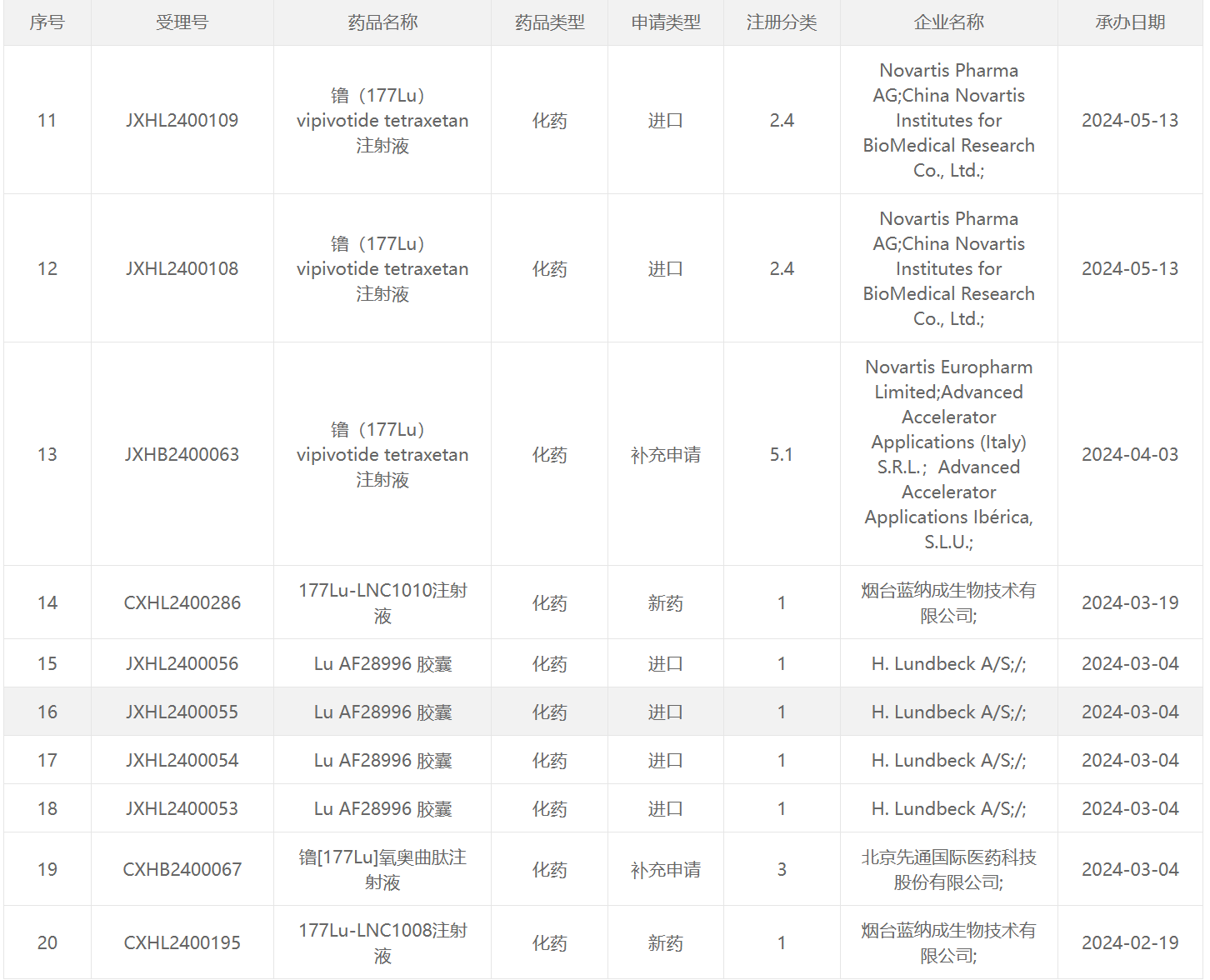
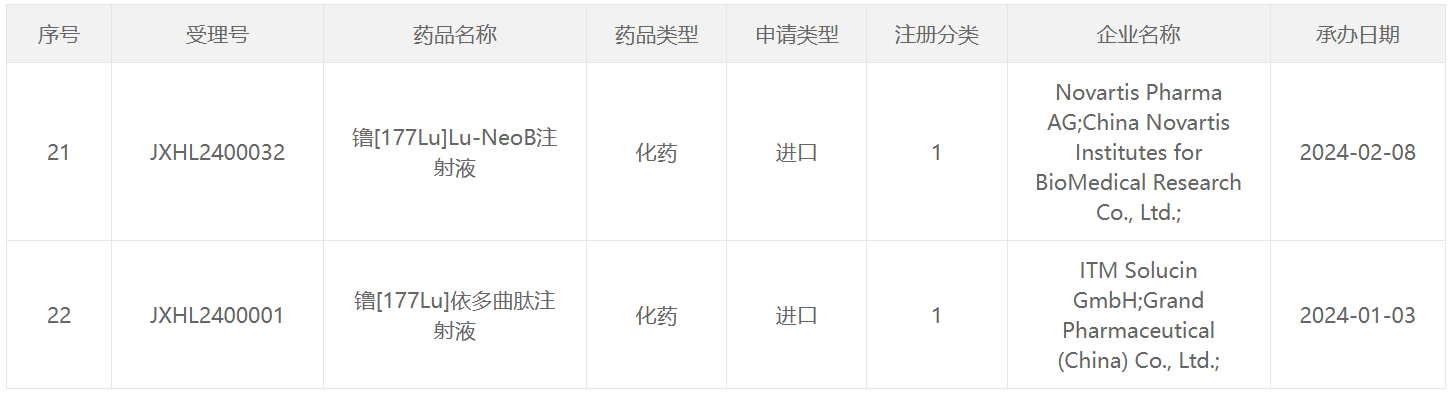
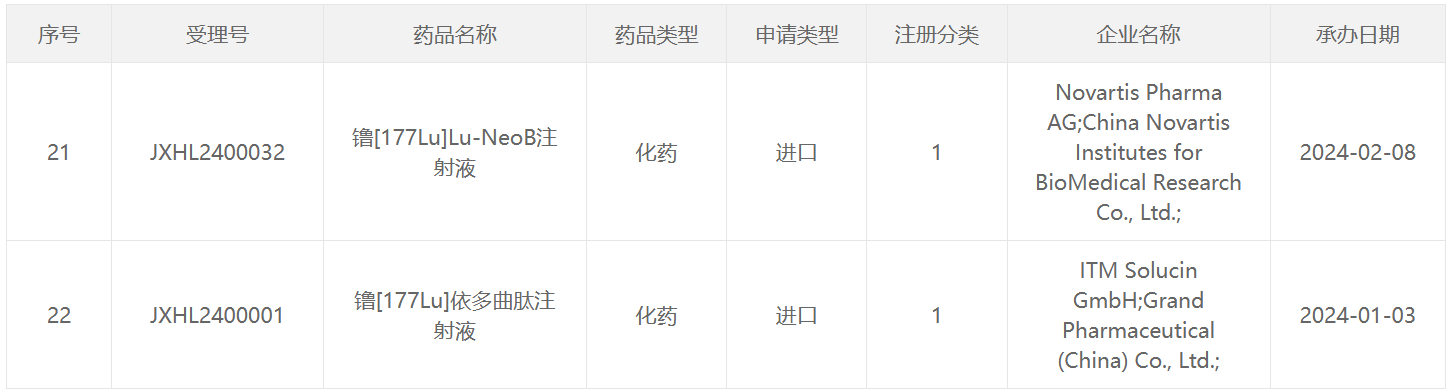
64 Cu类药物
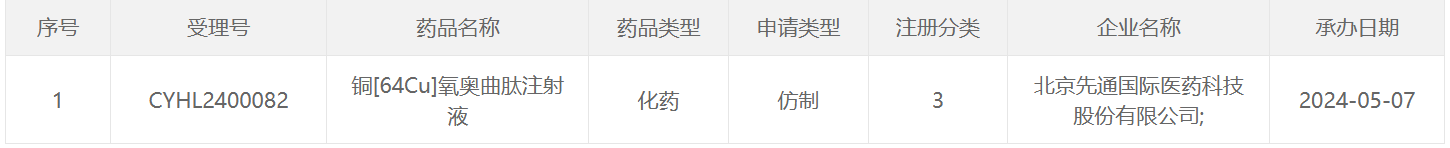
89 Zr类药物
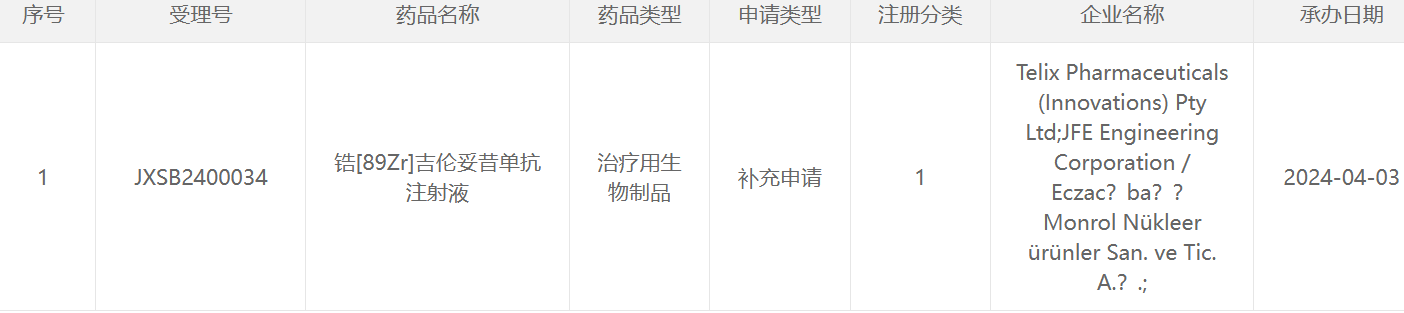
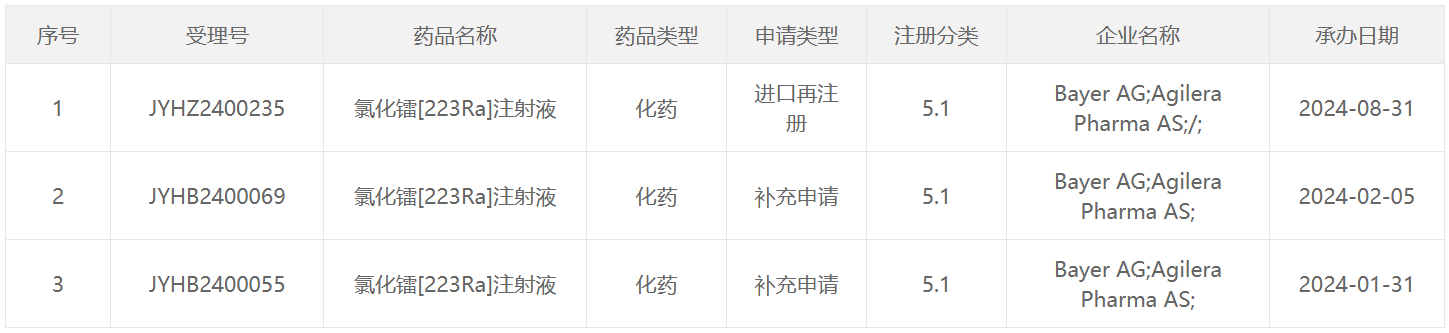
223 Ra类药物
90 Y类药物

125 I类药物
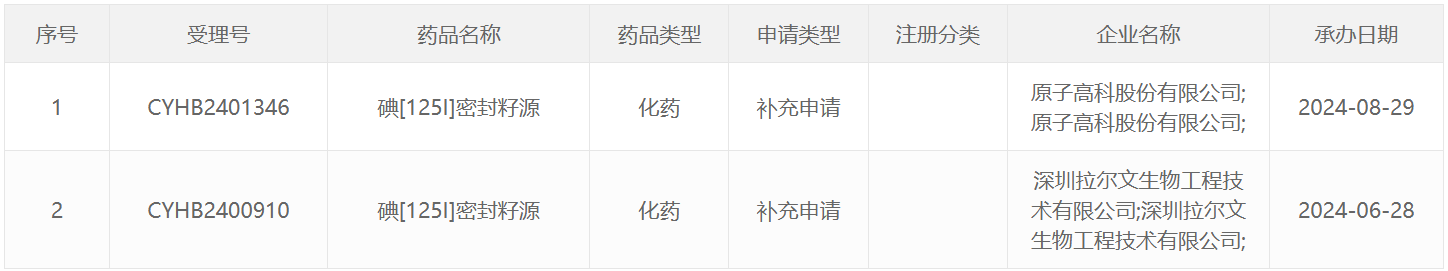
131 I类药物
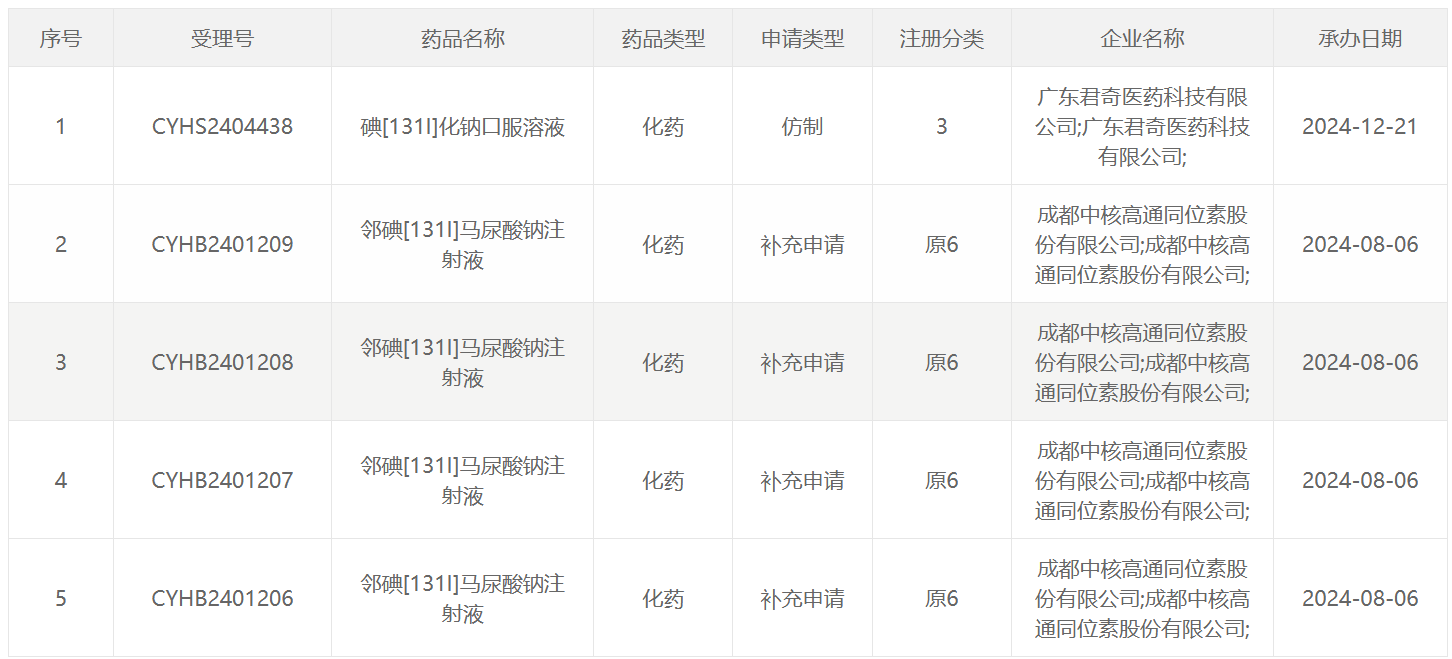
2025年CDE受理的放射性药物
18 F类药物
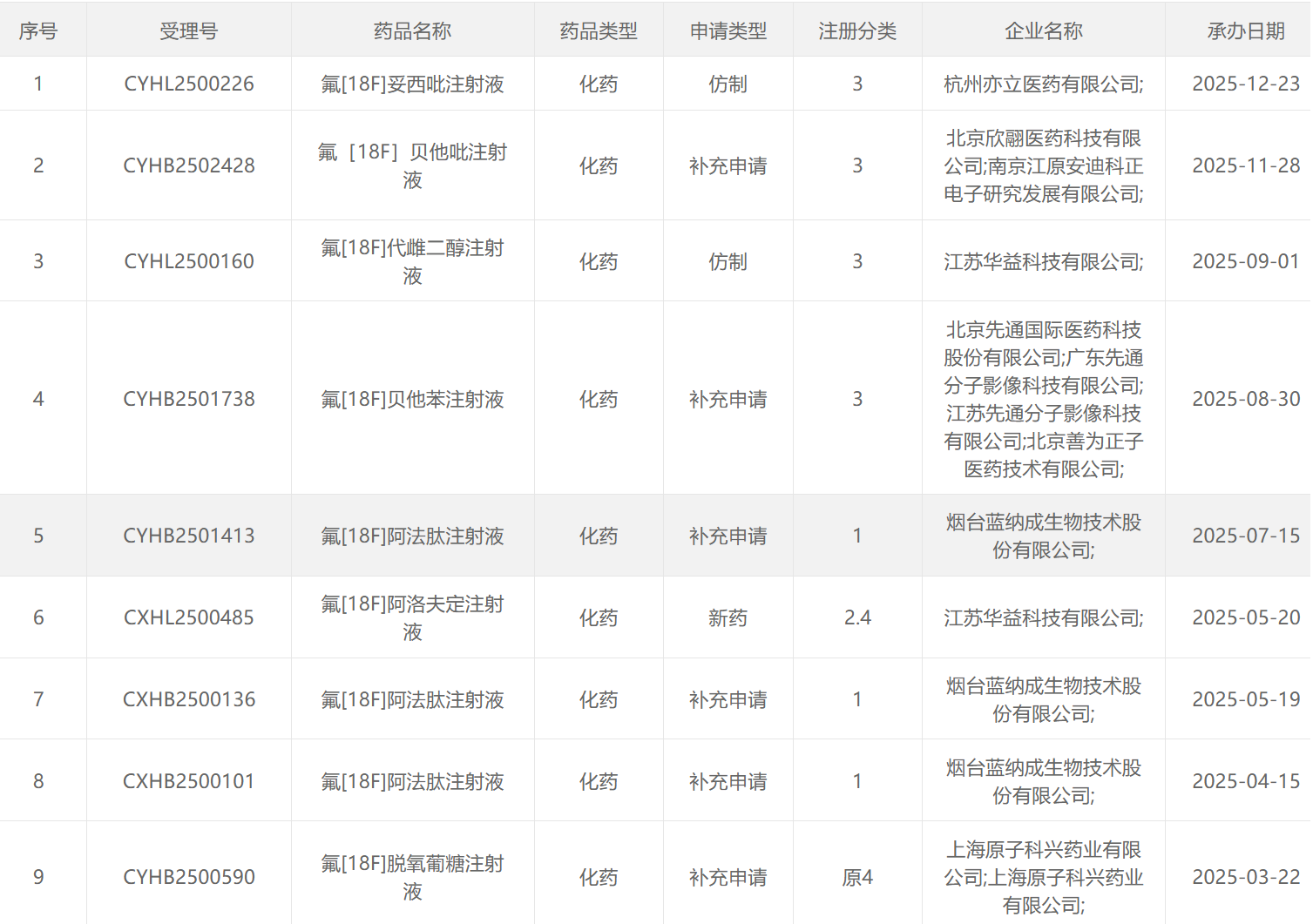
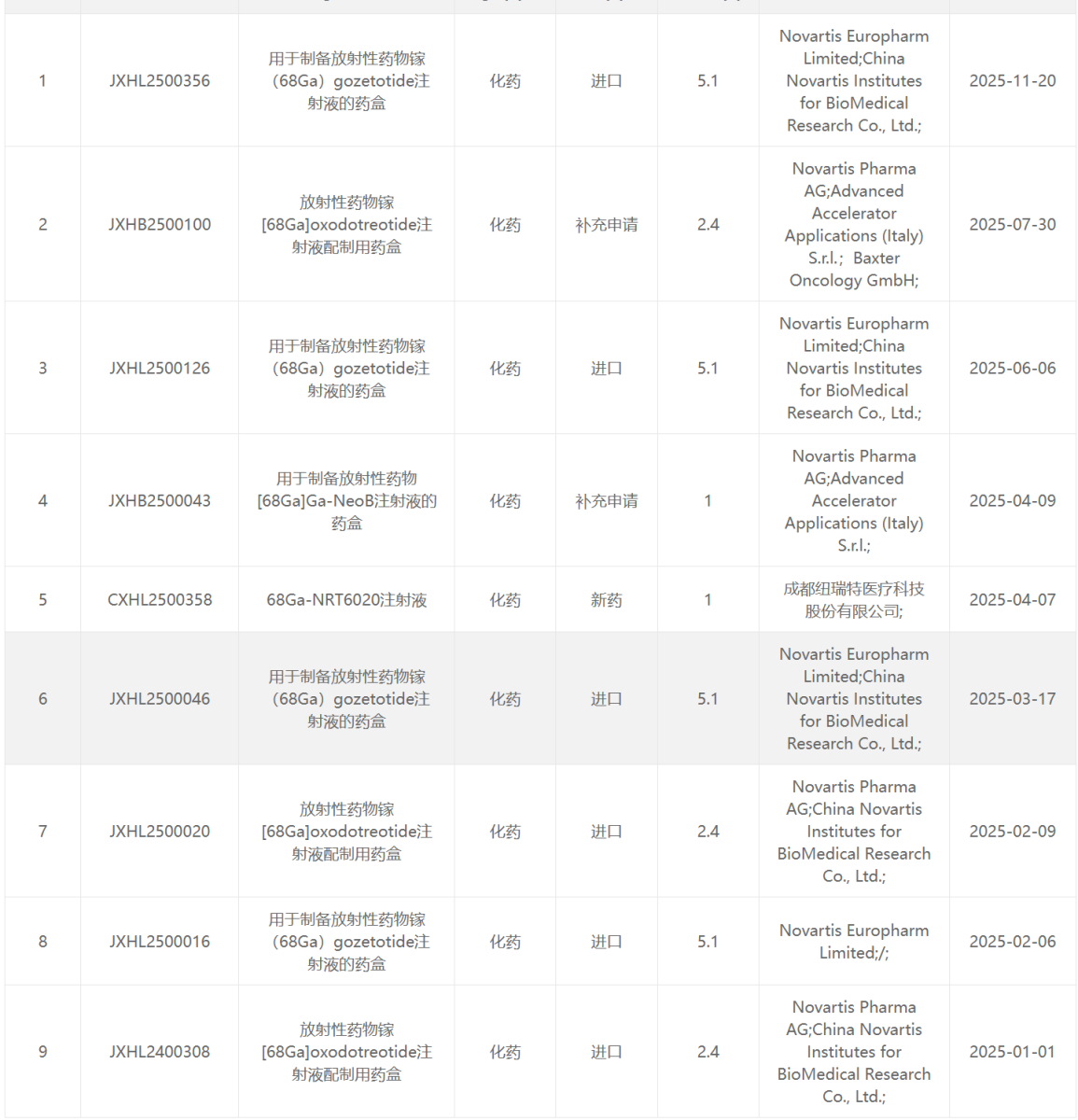
68 Ga类药物
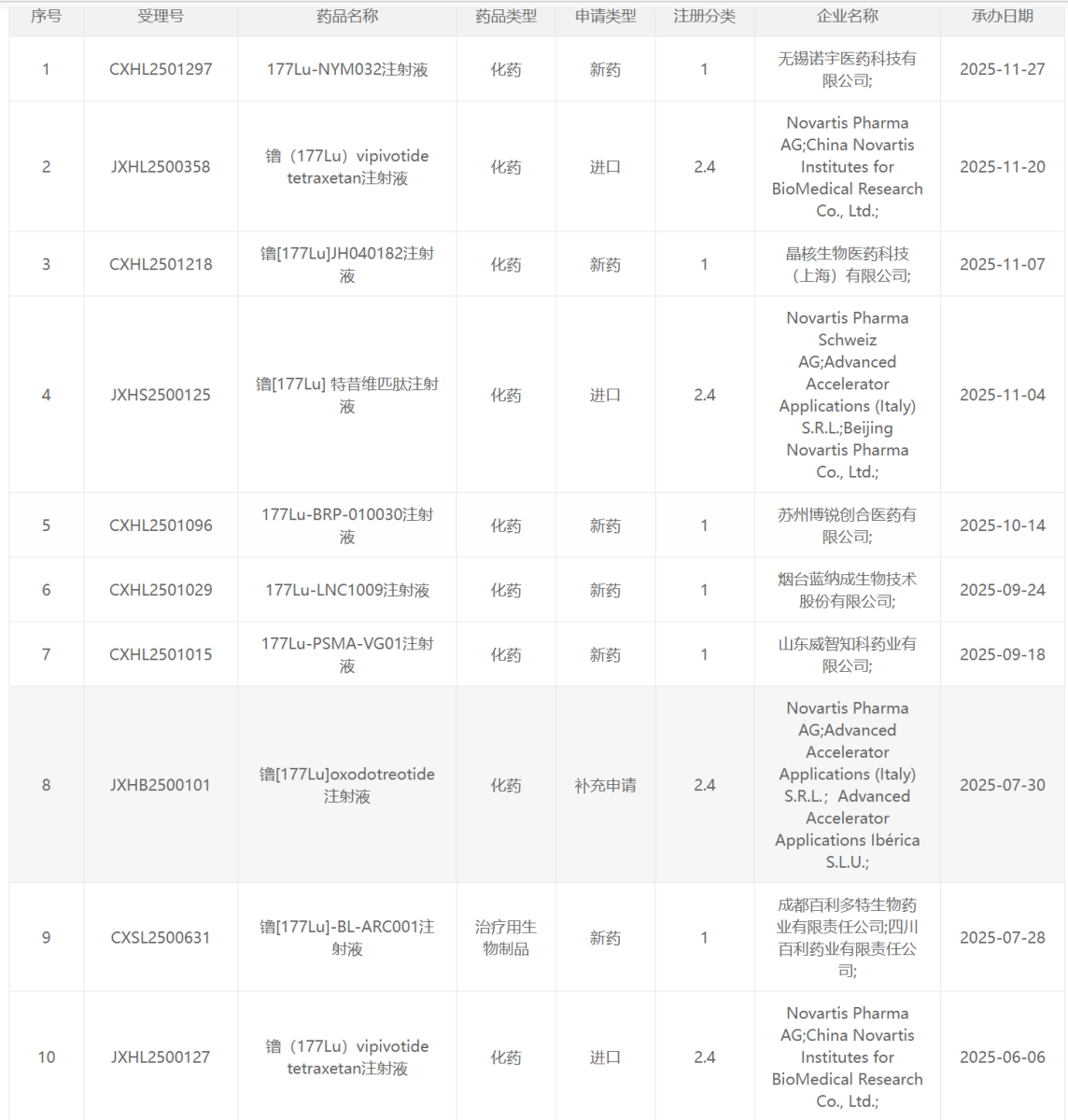
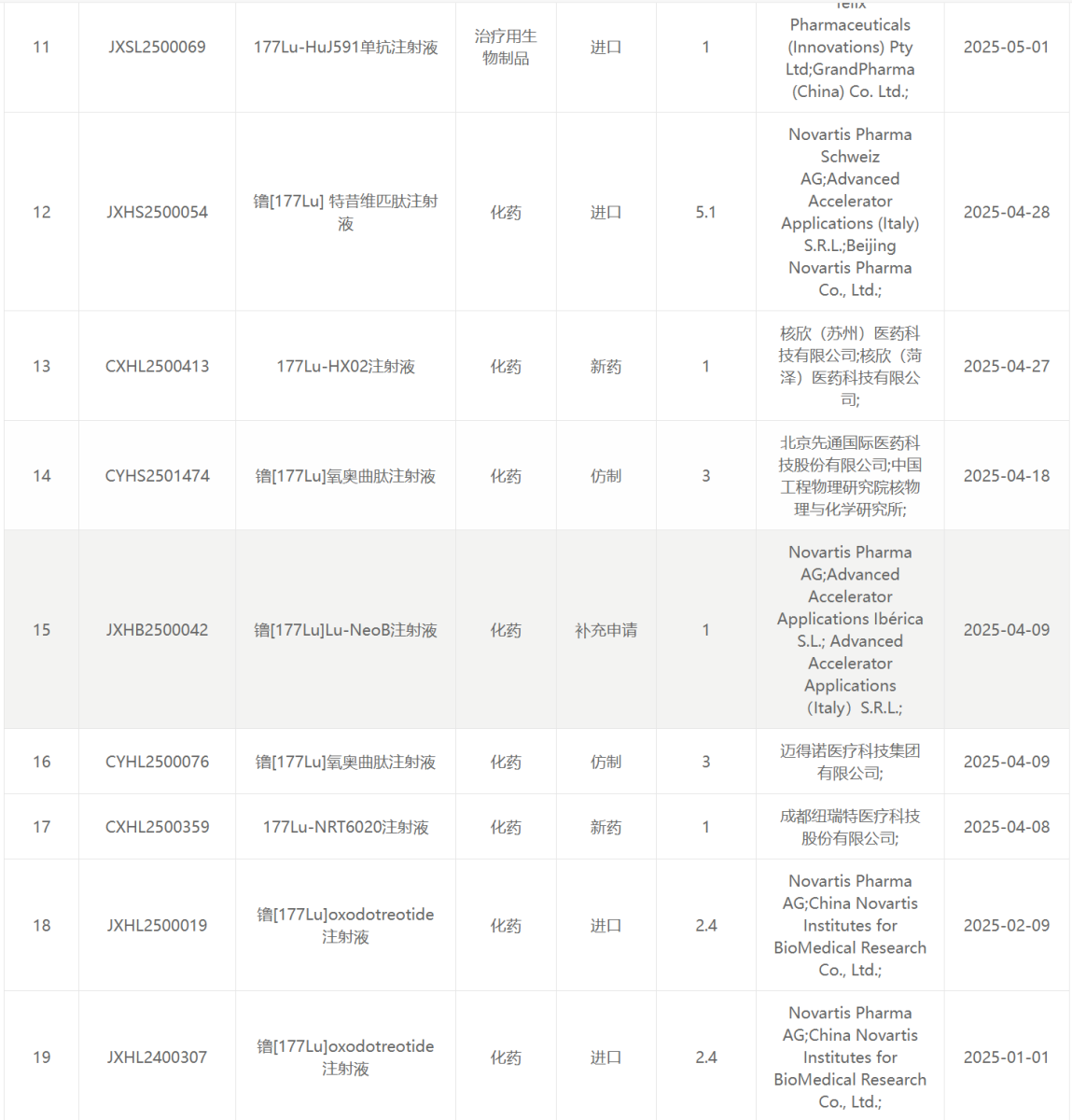
177 Lu类药物
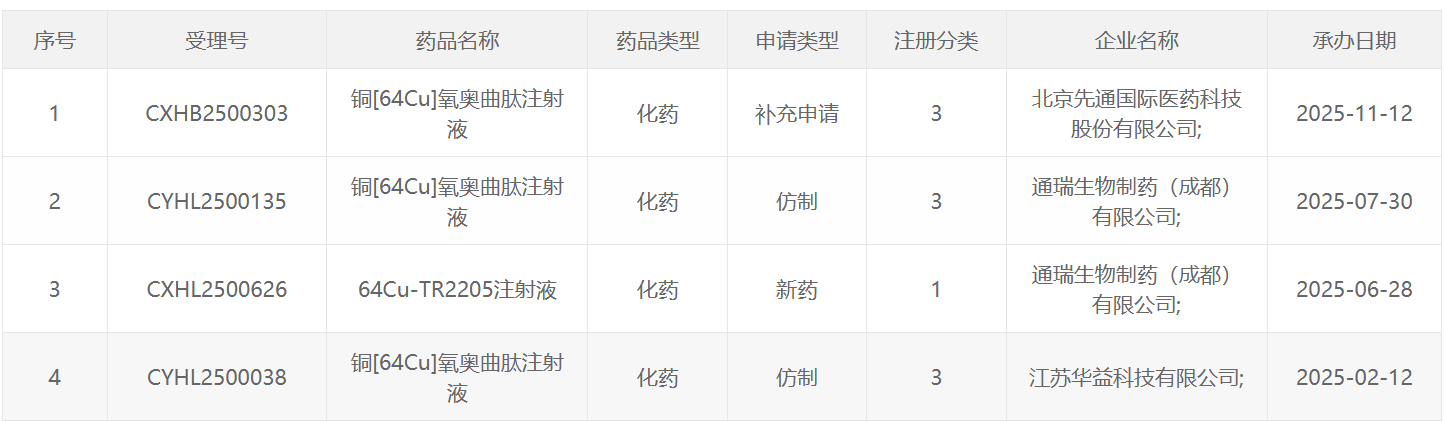
64 Cu类药物
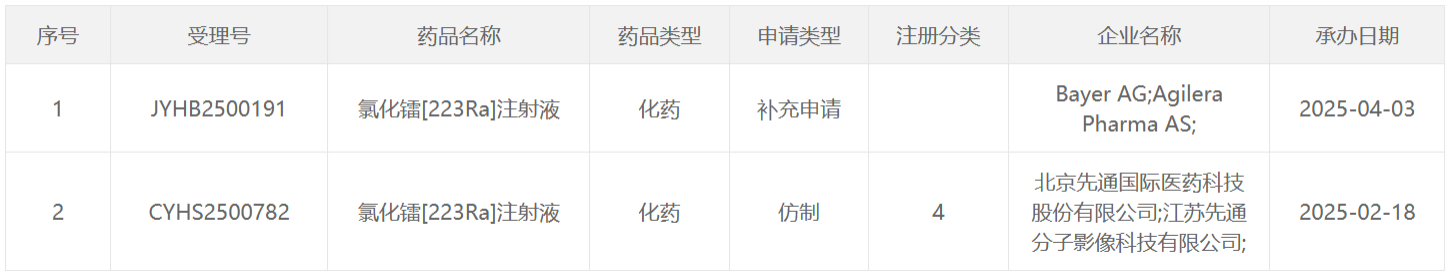
223 Ra类药物
90 Y类药物

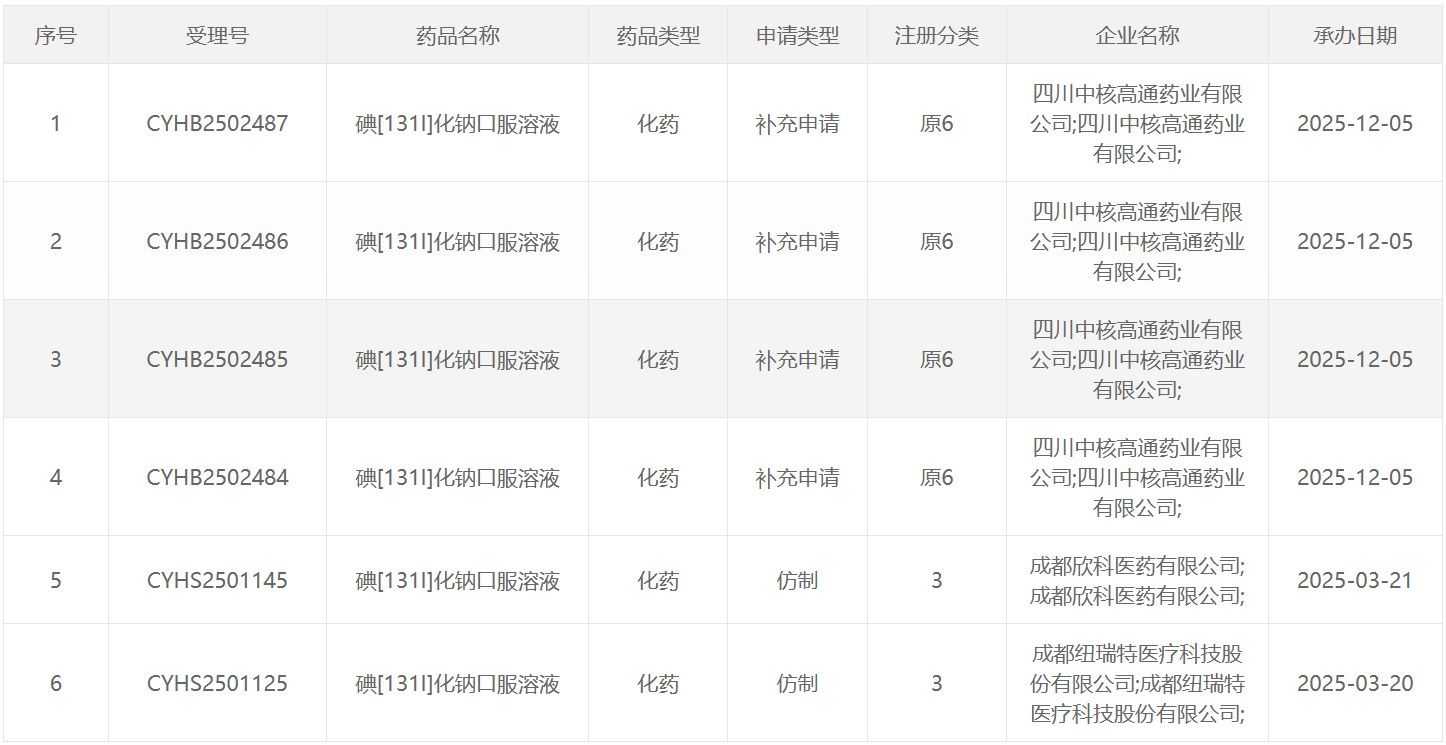
131 I类药物
撰写:芦鑫淼
审核:秦维伟