2026-01-30
有临来雅

适应性设计(Adaptive Design)是指允许根据试验参与者累积数据的期中分析结果,在不损害试验完整性与正确性的前提下,为试验进一步进行做出相应修改的临床试验设计。采用适应性设计需综合考虑诸多因素,特别是适应性设计的适用性、合理性、完整性和可行性。
常用的适应性设计包括成组序贯设计、样本量重新估计、适应性无缝剂量选择的设计、适应性富集设计、两阶段适应性设计和适应性主方案试验设计。本文简要介绍适应性II/III期无缝设计。
一、无缝设计特点
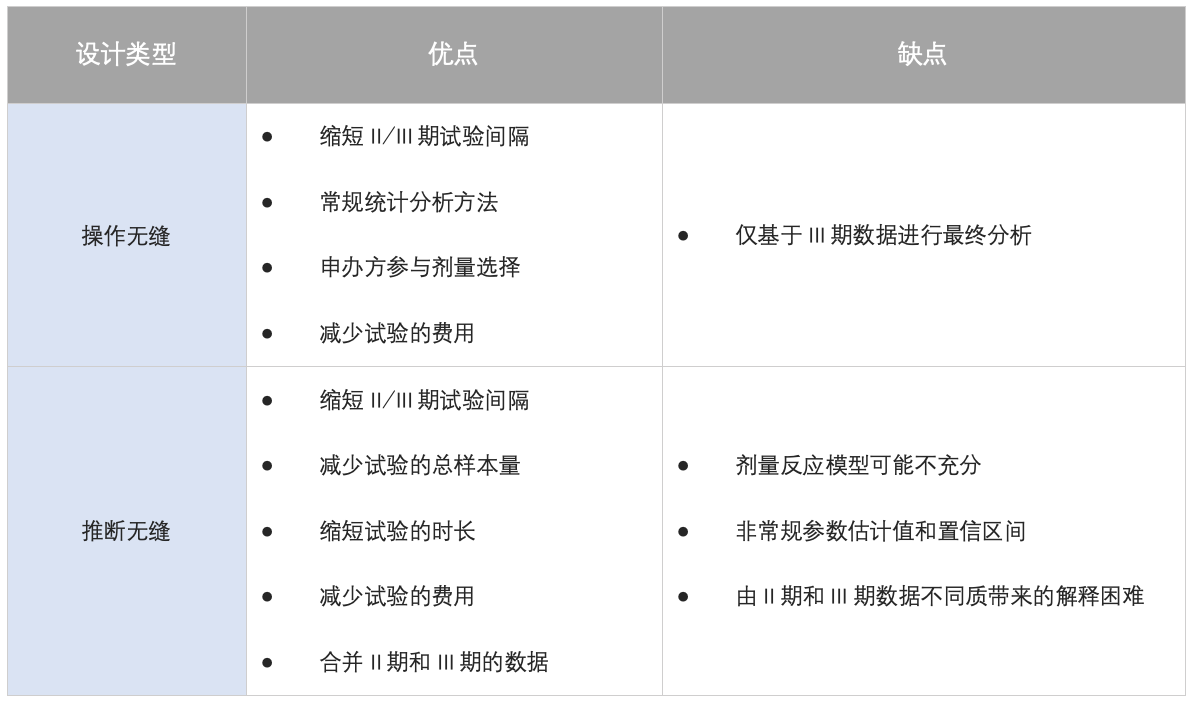
无缝设计是指将两个试验无缝连接,在前期试验结束时做剂量选择,并将所选剂量用于后期试验。无缝设计可以分为操作无缝和推断无缝。
操作无缝设计是指将II期试验的参与者排除在III期的最终分析之外,且不需要在III期的最终分析时对I类错误率进行调整。
推断无缝设计是指在最终分析时包含了选中剂量和未选中剂量的II期试验的所有参与者。且需要对I类错误进行调整。适应性II/III期推断无缝设计是其特例。
二、考虑因素
采用适应性 II/III 期无缝剂量选择的设计需要综合考虑:
三、实施步骤
适应性 II/III 期推断无缝设计的实施步骤如下:
在最终分析时,需将第1阶段与第2阶段的独立分析结果进行合并。常用方法有:
逆正态合并p值法:将各阶段的p值转换为标准正态分位数,按预设权重(如样本量)加权平均后,再进行反变换得到合并统计量。研究表明,在长短期终点相关性较好时,逆正态合并p值法的检验效能通常优于Fisher合并检验法,且对Ⅰ类错误的控制更稳定。
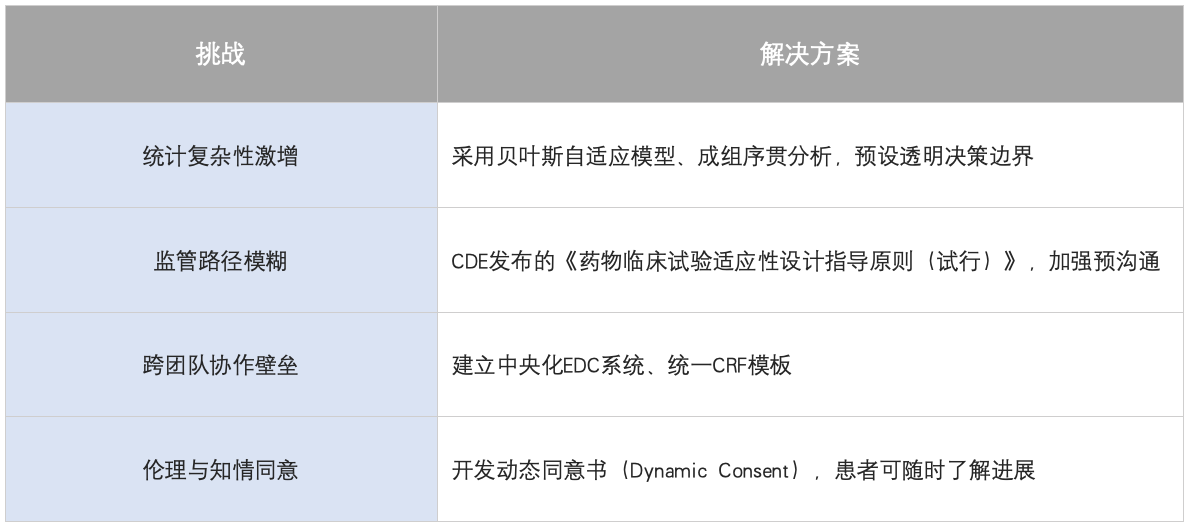
四、挑战与解决方案
五、总结
适应性 II/III 期无缝剂量选择设计是一项复杂的系统工程,成功的关键在于多学科团队的紧密合作(统计学家、临床医生、药理学家、项目负责人、法规事务、医学写作等)、严谨科学的顶层设计、与监管机构的充分沟通以及高效的试验运营执行能力。只有在充分考虑并妥善解决上述各方面因素的基础上,才能充分发挥无缝设计的优势,加速有效药物的研发进程,最终惠及患者。
在设计初期,强烈建议咨询经验丰富的统计学家和法规事务专家,并参考CDE发布的关于药物临床试验适应性设计相关的指导原则。
随着AI驱动的自适应算法、真实世界数据(RWD)融合、去中心化试验(DCT)技术的成熟,无缝设计将向更智能、更普惠的方向演进:
参考文献
[1] 国家药品监督管理局药品审评中心, 《药物临床试验适应性设计指导原则(试行)》, 2021年1月.
[2] 陈锋, 夏结来. 临床试验统计学[M], 人民卫生出版社, 2018.
[3] 陈锋, 于浩. 临床试验精选案例统计学解读[M], 人民卫生出版社, 2014.
撰写:王素丽
审核:冯雪