2026-01-23
有临医药

随着精准医疗的不断深入,CLDN18.2已成为实体瘤治疗领域最受关注的新兴靶点之一。作为紧密连接蛋白家族成员,CLDN18.2在正常组织中仅表达于胃黏膜分化上皮细胞,而在胃癌、胰腺癌等多种恶性肿瘤中高表达,且与肿瘤侵袭、不良预后密切相关。这一高度组织特异性的表达模式,使其成为理想的治疗靶点。
截至2025年底,全球针对CLDN18.2的研发管线已涵盖四大类药物——单克隆抗体、双特异性抗体、CAR-T细胞疗法和抗体偶联药物(ADC),形成了多层次、多机制的研发格局。中国企业在其中表现尤为突出,在多个技术路径上处于国际领先地位。
一、ADC类药物:疗效显著,引领研发热潮
抗体偶联药物(ADC)通过将靶向抗体与高效细胞毒性药物连接,实现了精准杀伤肿瘤细胞的目的。目前全球已有7款CLDN18.2 ADC进入III期临床研究阶段,展示了令人鼓舞的疗效数据。
表1: CLDN18.2 ADC III临床研究横向对比
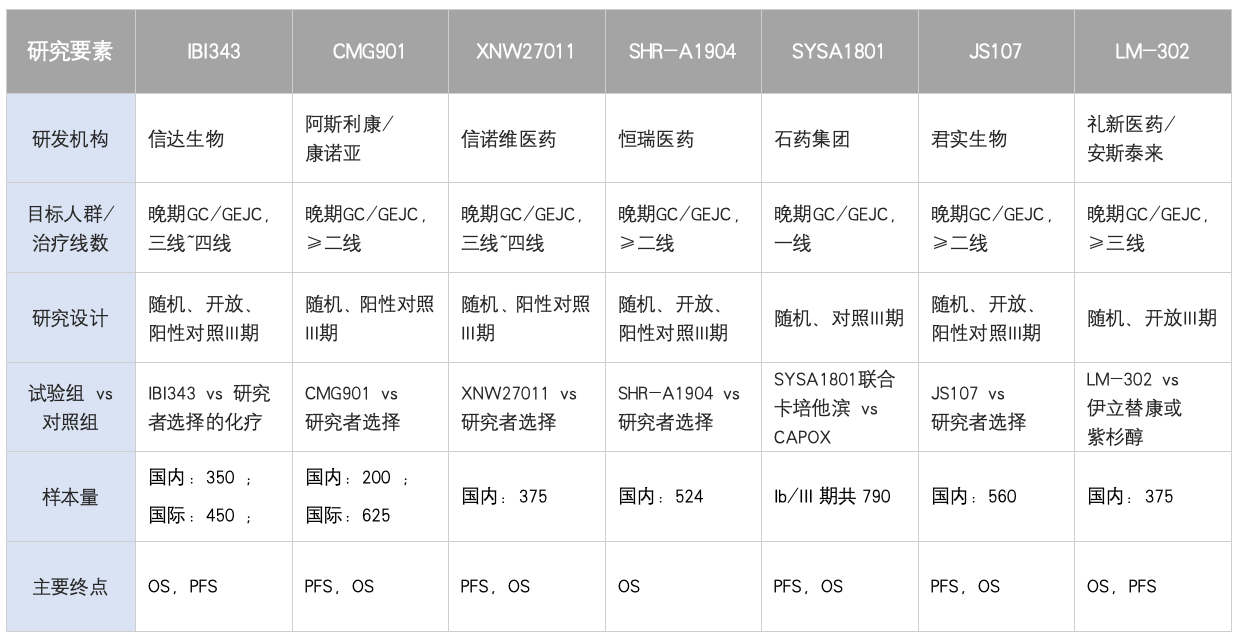
ADC疗效亮点与关键会议数据:
IBI343是信达生物开发的抗CLDN18.2 ADC,2025 年 7 月 16 日,《Nature Medicine》在线发表了 IBI343 治疗晚期胃或胃食管交界处腺癌的国际多中心 I 期临床研究数据。研究显示,在 6mg/kg 剂量组中,治疗 Claudin18.2 阳性(≥75% 肿瘤细胞,IHC≥2+)晚期 GC/GEJC 患者的 ORR 为 32.3%,DCR 为 90.3%,中位 PFS 为 5.5 个月,OS 尚未成熟;在 8mg/kg 剂量组中,ORR 提升至 47.1%,DCR 为 88.2%,中位 PFS 为 6.8 个月,中位 OS 未达[1]。
CMG901/AZD0901是乐普生物、康诺亚和阿斯利康共同开发的CLDN18.2 ADC。根据报道的I期临床研究结果显示推荐的II期剂量 2.2 mg/kg 下, Claudin18.2 阳性(≥20% 肿瘤细胞,IHC≥2+)晚期 GC/GEJC 患者的 ORR 为 47%,DCR 为 69%,中位 PFS 为 4.8 个月,中位 OS 为 11.8 个月[2]。
SHR-A1904是恒瑞医药自主研发的靶向 CLDN18.2 ADC,2025 年 7 月公布了 SHR-A1904 的 I 期临床研究结果显示,在晚期 GC/GEJC 患者中,6.0 mg/kg 及 8.0 mg/kg 剂量组的 ORR 分别为 24.2% 和 25.0%;中位 PFS 分别达到 5.6 个月和 5.8 个月。在 Claudin18.2 中高表达的患者中,6.0 mg/kg 及 8.0 mg/kg 剂量组的 ORR 分别为 26.7%和26.5%[3]。
XNW27011是信诺维研发的CLDN18.2 ADC。2025年ASCO公布I/II期数据剂量扩展队列共入组116例CLDN18.2+实体瘤患者,其中84例为胃癌/胃食管交界癌(GC/GEJC)患者,客观缓解率(ORR):GC/GEJC患者各剂量组(2.4、3.0、3.6mg/kg)的ORR为46.7%。疾病控制率(DCR):各剂量组DCR为88.0%[4]。
SYSA-1801在是石药集团研发针对Claudin18.2 的ADC药物,公布的I期数据显示,在7例Claudin 18.2的阳性(≥20%的肿瘤细胞在IHC 2+/3+下)的GC/GEJC患者, ORR为42.8%, DCR为71.4%[5]。
JS107 是君实生物自主研发的 CLDN18.2 ADC,2025 年ESMO年会上公布单药及联合特瑞普利单抗的I 期临床研究结果显示,联合特瑞普利单抗的GC/GEJC患者入组45例, ORR为75.6%, DC为97.8%;CLDN18.2高表达(≥40%的肿瘤细胞在IHC ≥2+)GC/GEJC患者(N=30)的ORR为80.0%,DCR为100%;PR2D时CLDN18.2高表达GC/GEJC患者(N=24)的ORR为79.2%,DCR为100%[6]。
二、单克隆抗体:首个获批,疗效确证
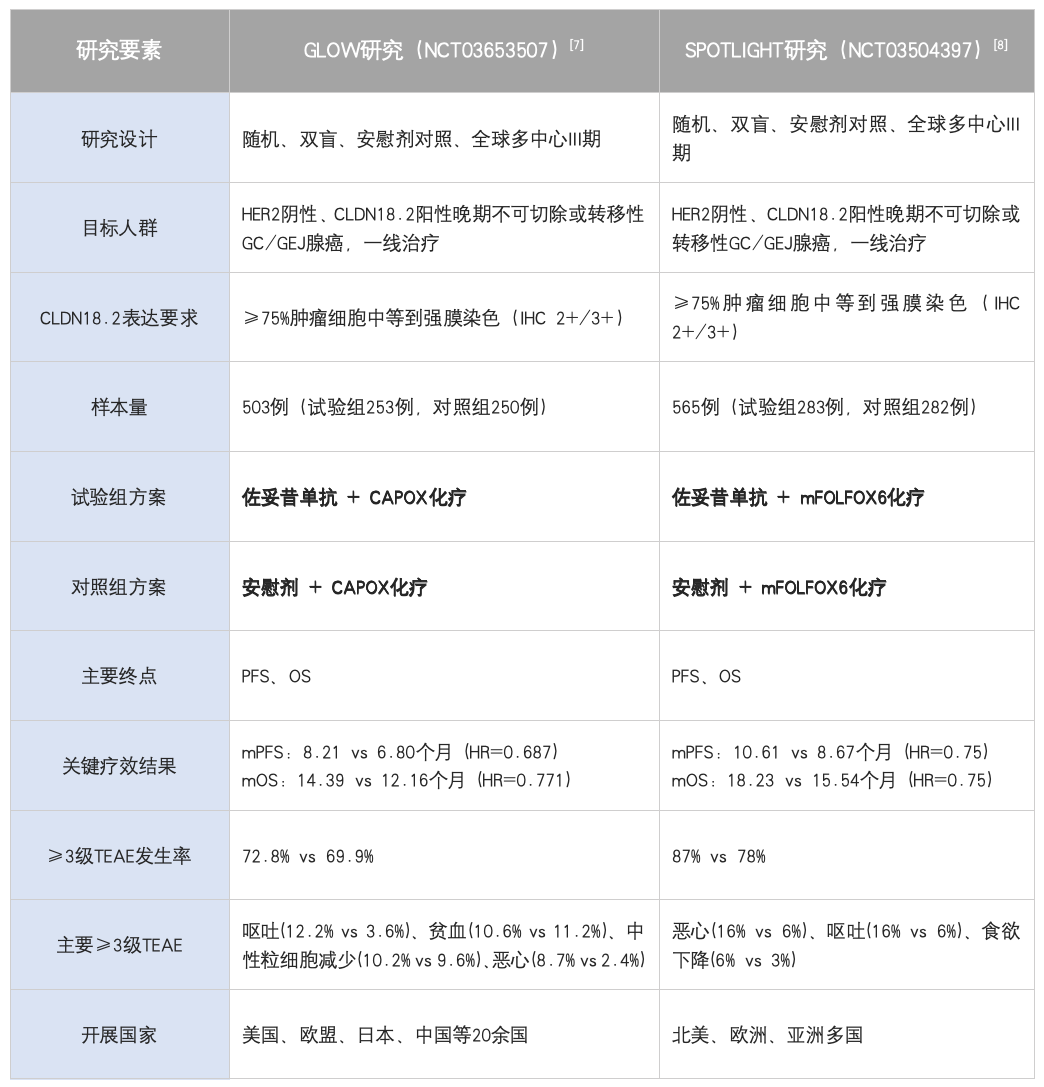
佐妥昔单抗(Zolbetuximab)作为全球首个获批的CLDN18.2靶向药物,其全球获批历程是基于两项关键III期研究(SPOTLIGHT和GLOW)的确凿证据。这两项全球多中心研究证实,该药联合标准化疗能显著改善CLDN18.2阳性、HER2阴性晚期胃癌患者的生存结局。基于此,该药自2024年起在全球主要市场快速获批:日本厚生劳动省于2024年3月率先批准;随后在欧盟、英国、韩国、美国及中国相继获批。在中国,国家药监局(NMPA)于2024年12月31日批准其上市,中国亚组数据也显示出与全球一致的获益。所有批准均要求患者为CLDN18.2阳性(定义为≥75%的肿瘤细胞显示中至强膜染色)且HER2阴性。
表2:佐妥昔单抗关键III期研究设计横向对比
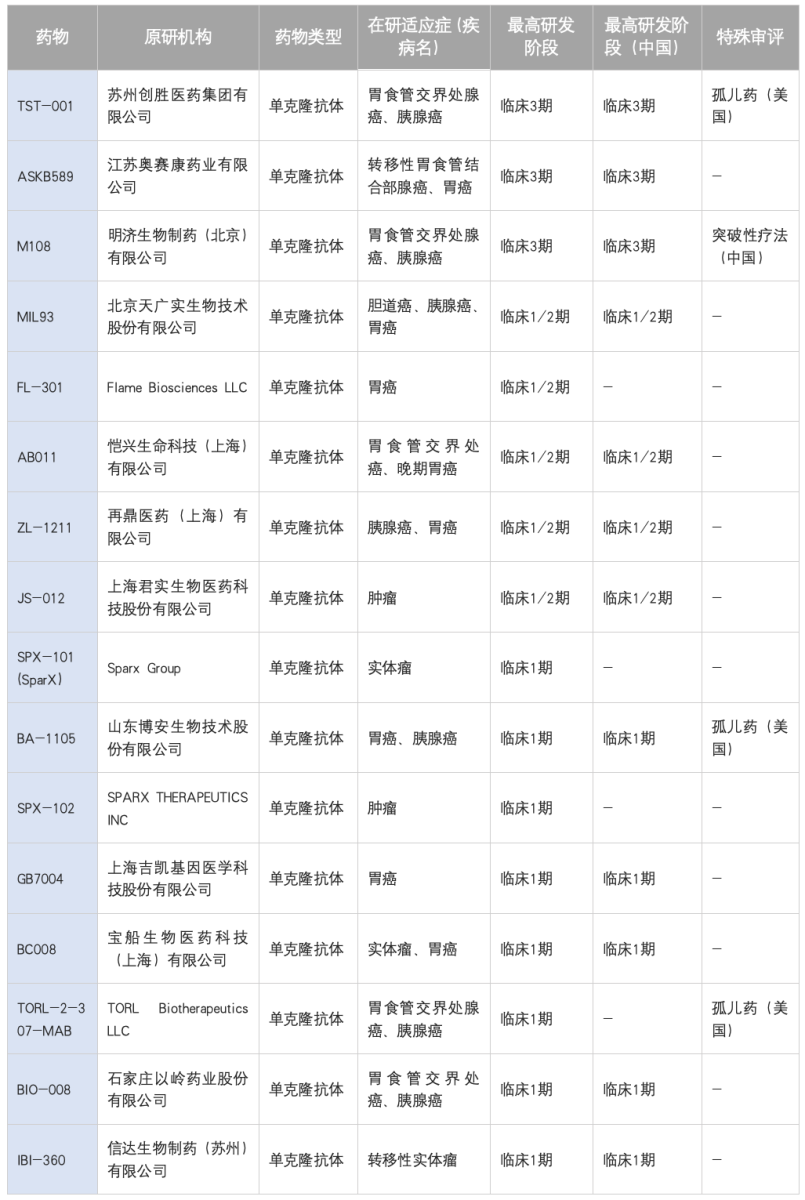
除佐妥昔单抗外其他进入临床研究的单抗如下表:
表3: CLDN18.2单抗临床研发现状
三、双特异性抗体:机制创新,前景广阔
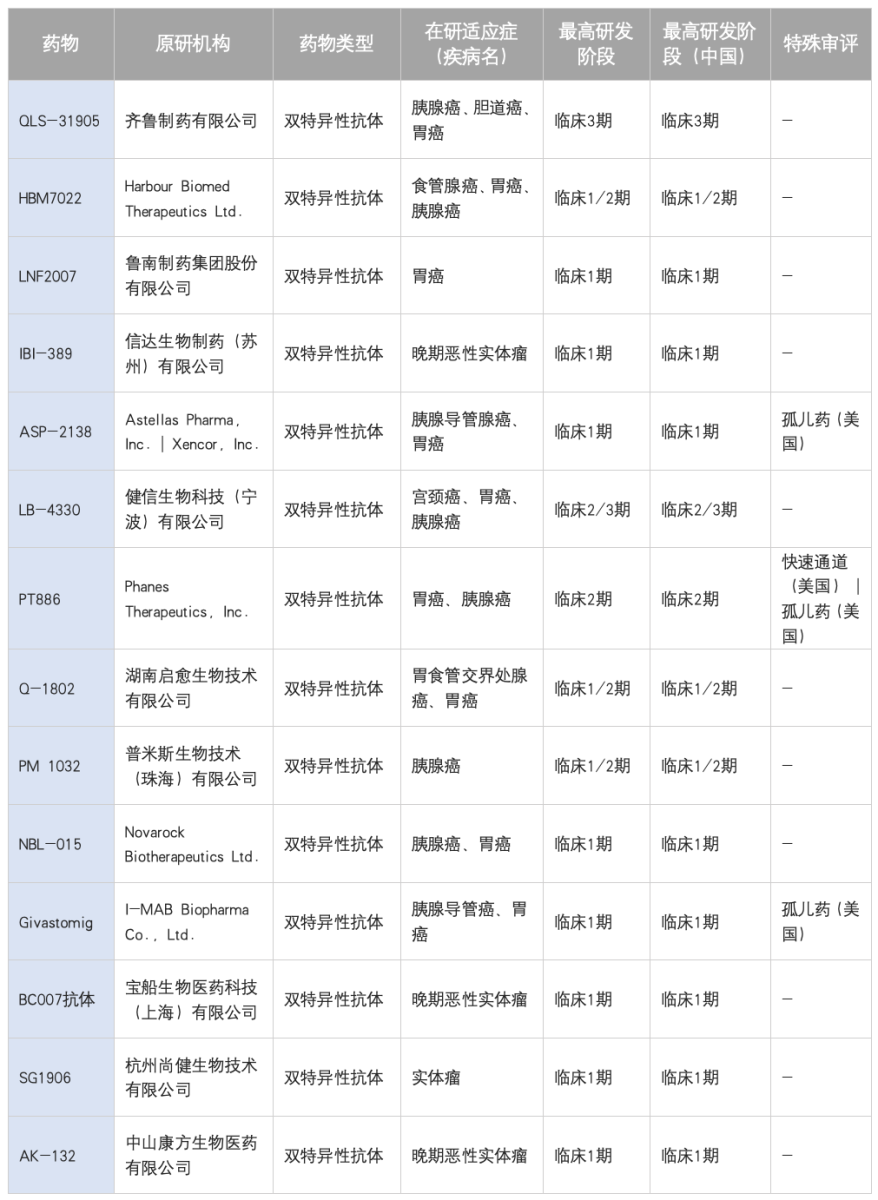
双特异性抗体是CLDN18.2靶向治疗领域的另一重要创新方向,其通过同时结合CLDN18.2与免疫细胞(如T细胞)表面的共刺激分子或检查点分子,实现更精准的免疫激活或调节。目前,全球已有十余款CLDN18.2双特异性抗体进入临床研究阶段,主要技术路径包括:1)T细胞衔接器(如靶向CD3):通过募集并激活T细胞直接杀伤肿瘤,以齐鲁制药的QLS31905为代表,已进入III期临床;2)免疫调节型(如靶向4-1BB):通过激活共刺激信号增强T细胞功能;3)免疫检查点双抗(如靶向PD-L1):在靶向肿瘤的同时解除免疫抑制微环境。早期临床数据显示出可控的安全性和初步的抗肿瘤活性,为晚期胃癌治疗提供了新的潜在选择。进入临床阶段的双抗如下:
表4: CLDN18.2双特异性抗体临床研发现状
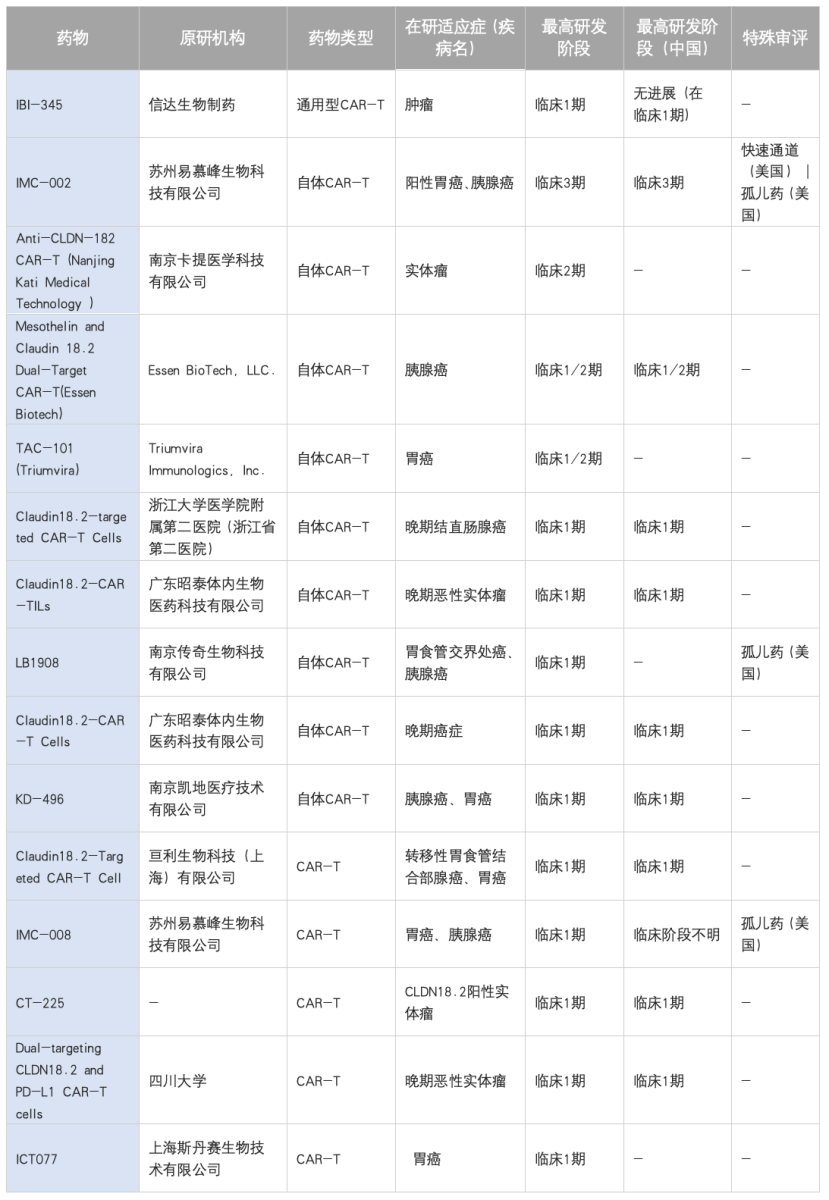
四、CAR-T细胞疗法:实体瘤突破,中国领先
CAR-T细胞疗法是CLDN18.2靶向治疗中最具突破性的领域之一。科济生物医药(上海)有限公司研发的舒瑞基奥仑赛(CT041),作为全球进展最快的自体CAR-T候选药物,已于2025年5月被中国国家药监局药品审评中心(CDE)纳入优先审评,其II期研究取得了里程碑式的成果,为实体瘤CAR-T治疗提供了首个高级别循证医学证据。
CT041-ST-01研究(NCT04581473)[9] 是一项全球首创的、针对实体瘤的CAR-T疗法随机对照临床试验,设计严谨,旨在评估CT041在标准治疗失败的晚期胃癌患者中的疗效与安全性。
除CT041外,国内其他企业也在积极布局,例如苏州易慕峰生物的IMC-002也已进入III期临床,南京传奇生物的LB1908等处于早期阶段,具体见下表。
表5:CLDN18.2CAR-T临床研发现状
五、未来展望与挑战
纵观CLDN18.2靶向治疗的全局发展,我们正站在一个从研发突破迈向临床实践转化的关键节点。单克隆抗体佐妥昔单抗的成功上市,为这一靶点的临床价值提供了首个确凿证据,并推动了伴随诊断的标准化。当前,以ADC和双特异性抗体为代表的下一代疗法正在快速推进,它们展现出更高的客观缓解率,并且联合免疫检查点抑制剂等策略显示出了巨大的协同潜力,有望进一步延长患者的生存期。在更具颠覆性的CAR-T细胞治疗领域,CT041在晚期胃癌后线治疗中取得的阳性II期结果,为实体瘤的细胞免疫治疗开辟了道路。然而,机遇与挑战并存。如何克服肿瘤异质性导致的耐药、优化不同作用机制药物之间的联合策略、明确最佳的生物标志物检测阈值以筛选最适宜人群、以及控制治疗成本以实现可及性,都是未来需要产业界、学术界和临床医生共同攻克的核心课题。随着全球尤其是中国创新力量的持续投入,预计未来3-5年内,CLDN18.2靶向治疗将从胃癌拓展至胰腺癌等更多瘤种,逐步建立起一个多元化、精准化的治疗新格局,最终改变晚期消化道肿瘤患者的治疗前景。
参考文献
[1]Liu J, Yang J, Sun Y, et al. CLDN18.2-targeting antibody-drug conjugate IBI343 in advanced gastric or gastroesophageal junction adenocarcinoma: a phase 1 trial. Nat Med. 2025;31(9):3028-3036.
[2]Ruan DY, Liu FR, Wei XL, et al. Claudin 18.2-targeting antibody-drug conjugate CMG901 in patients with advanced gastric or gastro-oesophageal junction cancer (KYM901): a multicentre, open-label, single-arm, phase 1 trial. Lancet Oncol. 2025;26(2):227-238.
[3]Ruan DY, Wu HX, Luo SX, et al. The antibody-drug conjugate SHR-A1904 for targeting CLDN18.2 in advanced gastric or gastroesophageal junction cancer: a phase 1 trial. Nat Med. 2025;31(9):3037-3046.
[4]Yu J, Sun Y, Zhao H, et al. Efficacy and safety of XNW27011, a Claudin 18.2 targeting antibody drug conjugate with topoisomerase 1 inhibitor payload, in patients with Claudin 18.2 positive gastric/gastroesophageal junction cancer: Results from ongoing phase I/II study. J Clin Oncol. 2025;43(16)(suppl 3034).
[5]https://www.prnewswire.com/news-releases/elevation-oncology-announces-promising-initial-data-from-phase-1-clinical-trial-evaluating-eo-3021-in-patients-with-advanced-unresectable-or-metastatic-solid-tumors-likely-to-express-claudin-18-2--302215418.html.
[6]https://cslide.ctimeetingtech.com/asia2025/attendee/confcal/presentation/list?q=LBA5&c=pnr
[7]Shah MA, Shitara K, Ajani JA, et al. Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial. Nat Med. 2023;29(8):2133-2141.
[8]Shitara K, Lordick F, Bang YJ, et al. Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial. Lancet. 2023;401(10389):1655-1668.
[9]Qi C, Liu C, Peng Z, et al. Claudin-18 isoform 2-specific CAR T-cell therapy (satri-cel) versus treatment of physician's choice for previously treated advanced gastric or gastro-oesophageal junction cancer (CT041-ST-01): a randomised, open-label, phase 2 trial. Lancet. 2025;405(10494):2049-2060.
撰写:赵瑜
审核:李晓梅