一、疾病简介及流行病学
帕金森病(PD)已成为全球第二大神经系统退行性疾病,主要病理表现为多巴胺(DA)能神经元进行性退变、路易小体的形成和纹状体区DA递质降低。PD的患病率为111~329/10万,在神经退行性疾病中仅次于阿尔茨海默病。PD的年发病率为10~18/10万,男∶女比例约为3∶2。年龄增长是PD重要的危险因素,平均发病年龄为60岁左右。我国65岁以上人群患病率为1.7%,预估2030年我国PD患病例数将达到500万例。
二、病因/发病机制
PD的致病因素多由遗传与环境共同作用的结果。遗传因素在PD的发病过程中扮演着重要角色,约10%的PD患者存在明确的家族遗传史。目前已发现多个与PD相关的致病基因,如 LRRK2、CHCHD2、Parkin、GBA等。PD的发病机制复杂,除了α-突触核蛋白外,还可能涉及溶酶体功能障碍、神经炎症等。
三、临床特征/诊断标准
PD的临床特征可分为运动症状和非运动症状,主要运动症状包括:动作迟缓、肌强直和震颤,晚期患者可表现出姿势平衡障碍。常见非运动症状包括:睡眠障碍、嗅觉障碍、自主神经功能障碍、认知损害和精神障碍。目前PD的诊断仍基于临床症状,根据国际运动障碍协会(MDS)于2015年推出的PD临床诊断标准。
四、治疗现状
目前,PD的主要治疗方式为药物和手术治疗。其中,药物治疗是最主要的治疗方式,常用药物包括:复方左旋多巴(L-dopa)制剂、多巴胺受体(DAR)激动剂、单胺氧化酶B型(MAO-B)抑制剂、儿茶酚氧位甲基转移酶(COMT)抑制剂、抗胆碱能药物等。PD药物以对症治疗为主,尚缺乏能够延缓或阻止疾病进展的疗法。尽管对症治疗可使大部分患者的症状在一开始得到缓解,但随着病程的发展,中晚期阶段PD患者可能出现运动并发症,严重影响患者的生活质量。脑深部电刺激术(DBS)是PD运动症状控制的另一种可行方案。通过手术的方式,将刺激电极植入脑内来改善PD运动症状,该疗法能提高患者的生活质量。因DBS属于有创治疗,另外最佳治疗时间也存在一定争议。磁共振引导聚焦超声(MRgFUS)已成为一种有前景的非侵入性技术,用于治疗对药物治疗抵抗的PD患者。无论在服药或未服药状态下,MRgFUS 都能显著降低运动障碍评分,但其治疗效果可能随时间的推移而减弱。
五、全球PD在研状况
截至2025年10月,clinicaltrials.gov上登记的有关PD治疗正在进行的临床试验数量超过660项,其中80%处于Ⅰ/Ⅱ期临床试验开发阶段,显示PD领域的研发仍主要集中在早期开发阶段。目前针对PD的临床研究方向主要包括对症治疗、疾病修饰、神经保护及基因/细胞疗法。
对症治疗
目前在研管线主要集中在L-dopa优化剂型和DAR激动剂。L-dopa从1960年代起应用于PD至今,仍然是治疗PD最有效的药物。当前多种新技术的开发主要分为新型口服给药剂型(新型控制/缓释剂型)和非口服给药剂型(吸入制剂、肠道给药、皮下注射),其目的为解决L-dopa吸收不稳定的问题。DAR激动剂相关药物的研发仍聚焦在提高与DA受体的亲和力上,并对DA受体产生平衡激动作用。
疾病修饰
对于携带致病性基因突变的帕金森病患者治疗,纠正突变基因所致酶缺陷的生物疗法正成为一种新方向。热门在研靶点主要集中在α-突触核蛋白、LRRK2和GBA等。
- α-突触核蛋白是一种在中枢神经系统中广泛分布的突触前蛋白,是PD病理标志物路易小体的主要组成成分。为寻找PD的疾病修饰疗法,正在探索多种直接或间接针对α-突触核蛋白聚集的方法。目前进展最快的是Annovis Bio制药公司的Buntanetap口服小分子药物,已完成III期临床试验,研究结果表明其在改善运动和非运动症状以及早期PD患者的认知功能方面是安全有效的,其有可能成为靶向α-突触核蛋白第一个上市的药物。除小分子药物外,靶向α-突触核蛋白的还有单抗、双抗大分子药物及疫苗等也在临床研发阶段,详见表1。
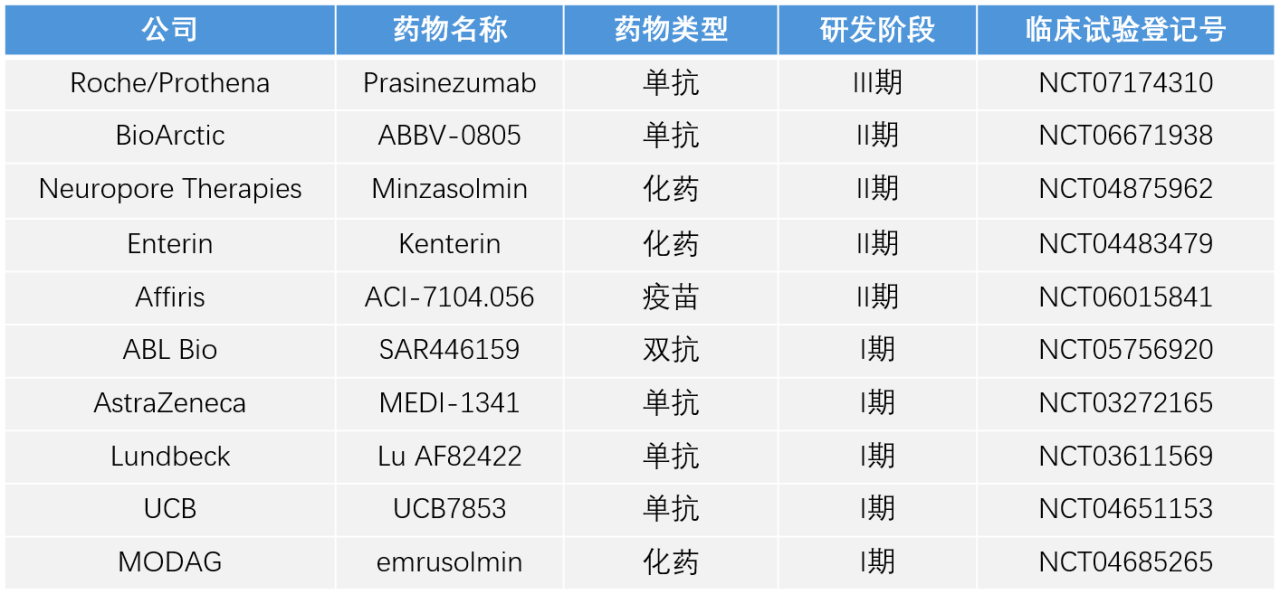
表1 靶向α-突触核蛋白全球在研药物概览
- LRRK2基因是目前PD最常见的显性致病基因,LRRK2突变会导致病理蛋白激酶活性增强,通过药物抑制蛋白激酶活性已被证明能够改善神经系统疾病。LRRK2激酶抑制剂研发最快的药物为BIIB122,其I期临床试验结果表明总体耐受性良好,无严重不良事件;该药物进入III期临床试验后目前已终止开发,未报告终止开发原因。BIIB122的另一项PD试验LUMA研究中国也参与了其中,目前已进展到IIb期临床试验阶段。LRRK2作为PD疾病修饰疗法中希望的靶点,但也面临一定挑战——缺乏可靠检测LRRK2活性的生物标志物和检测方法。其他LRRK2激酶抑制剂在研药物进展情况详见表2。
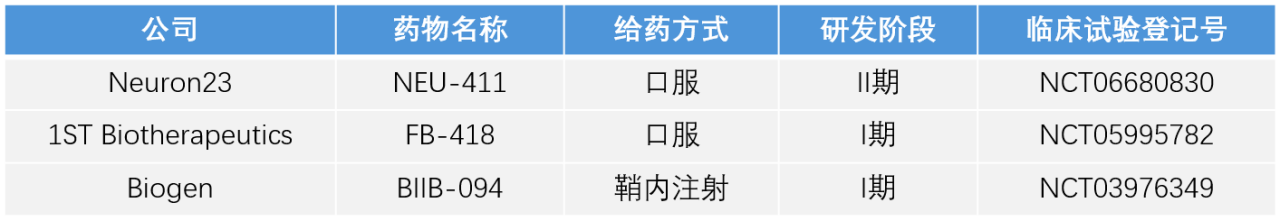
表2 LRRK2激酶抑制剂全球在研药物概览
- GBA基因突变可导致葡萄糖脑苷脂酶(GCase)活性降低,其与路易小体病理过程相关。GBA1突变大幅增加了罹患PD的风险,约7%~10%的PD患者人群存在GBA1突变。针对GBA突变PD的靶向治疗,目前进展较快的药物为BIA 28-6156,已进入临床II期试验阶段,其Ⅰb期临床试验结果显示在GBA突变的PD患者中总体耐受性良好,并明显提升GCase活性。PR001通过基因疗法病毒载体AAV9将健康的GBA1基因拷贝传递,目前正在进行Ⅰ/Ⅱ期临床试验。
神经保护疗法
主要通过减少神经元死亡和改善神经健康来改变PD疾病轨迹。这一领域的治疗策略主要包括抗氧化应激、抗炎、抗凋亡以及提供神经营养支持等。
- 目前老药新用也是PD治疗的另一个重要研究方向,如胰高血糖素样肽-1受体(GLP-1R)激动剂被寄望用于PD的神经保护作用。一项随机对照试验验证了靶向GLP-1R针对早期PD患者的疗效,结果显示,Lixisenatide连续皮下注射12个月后,运动评分明显优于对照。提示GLP-1R激动剂可能减缓PD疾病进展。
- 研究发现,过度激活c-Abl 被认为与氧化应激和α-突触核蛋白病理相关。IkT-148009是一种选择性的c-Abl 激酶抑制剂,其在PD患者中的I期临床试验结果表明耐受性良好并有效抑制c-Abl 活性。目前 IkT148009 已进入II期临床,用于评估长期给药是否能够保护神经元并延缓PD症状进展。
- KM-819为FAF1蛋白抑制剂,通过抑制神经细胞凋亡发挥神经保护作用,目前正在开展 I/II期临床试验。
基因治疗
基因疗法通常利用病毒载体将治疗基因递送至脑细胞,以提高多巴胺合成或释放神经营养因子。正在进行中的基因治疗临床试验主要集中在芳香族氨基酸脱羧酶(AADC)和神经胶质细胞源性神经营养因子(GDNF)方面。
- Genzyme公司研发的AAV-hAADC-2为首个在PD患者中开展的AADC基因治疗。I期临床试验入组10 例中度至重度PD患者,术后 6 个月UPDRS-III运动评分较基线改善了32%;此外,8例PD患者降低了多巴胺能药物的日常使用剂量。
- 拜耳子公司AskBio开发的AB-1005 是一种AAV2 载体的 GDNF 基因疗法,通过一次性手术将载体注射到纹状体,使患者自身的细胞持续产生GDNF。I期临床试验中,患者术后随访18个月仍是安全的。目前该疗法已进入II期临床以评估疗效。
细胞治疗
PD细胞疗法通过移植外源细胞来替代死亡的黑质多巴胺神经元,从而恢复纹状体通路功能。细胞来源已从最初的脑组织移植发展到多能干细胞定向分化的成熟神经前体细胞。
- 近期,拜耳公司针对PD的创新细胞疗法的Bemdaneprocel取得重大进展,首例PD患者已在关键性III期临床试验exPDite-2中接受治疗。Bemdaneprocel是一种现货型同种异体干细胞衍生疗法。该疗法由人胚胎干细胞产生的多巴胺能神经元组成,通过外科手术植入PD患者大脑的特定区域。这些移植的细胞在被植入后将继续发育成成熟的多巴胺神经元,并有可能重建被PD破坏的神经网络,从而恢复患者的运动和非运动功能。其I期临床试验术后24个月结果表明,高剂量组患者表现出显著临床改善:ON状态的时间平均增加1.8小时,而OFF状态时间减少1.9小时;MDS-UPDRS第III部分评分减少21.9分;MDS-UPDRS第II部分评分改善3.4分。在安全性方面,24个月内未报告与疗法相关的严重不良事件。exPDite-2试验作为一项关键性随机、双盲、假手术对照III期临床试验,代表了PD在细胞治疗领域的重要里程碑。
- 诱导多能干细胞(iPS细胞)与人胚胎干细胞(hES细胞)在帕金森病治疗中的应用探索也取得积极结果。日本京都大学研究团队一项I/II期临床试验,共有7例PD患者参与,接受iPS细胞来源的多巴胺能神经元前体细胞移植。结果表明,6例接受疗效评估的患者中,4例在MDS - UPDRS III部分OFF评分中有改善,5例在ON评分中有改善。纹状体的18F-DOPA Ki值增加44.7%,高剂量组增幅更高。安全性方面,未出现严重不良事件。
- 近日,来自国内一家生物医药公司中盛溯源研发的NCR201注射液诱导多能干细胞(iPSC)衍生多巴胺能神经前体细胞(iDAP)取得重大临床突破。1例早发型帕金森病(EOPD)患者,接受NCR201治疗后,术后3个月经综合评估实现了初步功能性治愈,运动功能显著恢复,生活质量全面恢复,多项关键指标恢复至正常水平。这是全球首次报道EOPD患者达到成功能性治愈的里程碑事件,标志着PD治疗领域迎来历史性进展。
- 纪念斯隆凯特琳癌症中心研究团队开展了一项接受hES细胞来源的多巴胺能神经元前体细胞移植的I期临床试验,共12例PD患者参与。术后18个月,纹状体的18F-DOPA PET摄取增加。MDS - UPDRS III OFF评分改善,未出现移植诱导的运动障碍。安全性方面,术后1年未出现与细胞产品相关的不良事件。
iPS细胞和hES细胞来源的多巴胺能神经元前体细胞移植在已在PD治疗中观察到了积极结果。不过,未来仍需开展更大规模临床试验,进一步评估其有效性与安全性。
参考文献:
[1] Parkinson disease therapy: current strategies and future research priorities. Nat Rev Neurol. 2024 Dec;20(12):695-707.
[2] The bluebook for Parkinsonian Disorders in China. Chin J Clin Neurosci 2024, 32 (Supple), 001~041.
[3] Phase I/II trial of iPS-cell-derived dopaminergic cells for Parkinson’s disease. Nature. 2025 May;641(8064):971-977.
[4] Phase I trial of hES cell-derived dopaminergic neurons for Parkinson’s disease. Nature. 2025 May;641(8064):978-983.
撰写:韩飞
审核:李晓梅


