2025-05-19
如初

科学界公认分子生物学时代是自1953年詹姆斯·沃森(James Watson)和弗朗西斯·克里克(Francis Crick)发现DNA双螺旋结构开始的。随着分子生物学的深入发展,人类已逐步揭示了遗传信息传递的基本规律,即从DNA到RNA再到蛋白质。简单地说,携带着遗传信息的DNA先转录为RNA,RNA中的信使RNA(mRNA)再被翻译制造出各种蛋白质,蛋白才是完成生命功能的执行者。在这一过程中,DNA、RNA和蛋白质任一环节出现错误都可能导致异常生理现象或疾病。
在分子生物学兴起之前,临床治疗药物的研发主要聚焦于蛋白质为靶点的筛选与开发。例如大多数小分子降脂药(详见《说说血脂那些事》)是针对胆固醇合成酶(一种蛋白质)设计的。这种酶一旦与降脂药结合后,活力就会下降,从而减少胆固醇的生成,最终达到降血脂的目的。治疗肿瘤的靶向药也是通过肿瘤所特有的异常蛋白来发挥治疗作用,比如通过抑制肿瘤中活跃的血管内皮生长因子(vascular endothelial growth factor,VEGF,也是一种蛋白)而扼制肿瘤的发展(详见《真正可以“饿死”癌细胞的办法》)。还有一些药物本身即是蛋白,通过模仿正常的生理功能达到治疗作用。例如治疗糖尿病的各种人工合成/半合成胰岛素,以及免疫疗法里的单抗药物。然而,能否通过“源头管控”的方式,靶向作用于蛋白质合成的“信息流”,从根本上改变蛋白功能?这是分子生物学发展至今对制药业提出的新挑战——以编码蛋白质的核糖核酸作为治疗药物。
虽然同样将核糖核酸作为药物,与以 DNA 为载体或操作对象的药物/治疗的基因治疗不同,核酸药物(nucleic acid therapeutics)是指以 RNA ,特别是指以mRNA为靶标的药物/治疗的方法。新冠期间,被大家所熟知的莫德纳疫苗,就是一种mRNA。它本身不是病毒,但进入体内细胞后,能够编码出存在于SARS-CoV-2表面的S蛋白(抗原,不具有病毒的作用)来诱导身体对新冠病毒的免疫力。这类核酸药物是将传递的信号表达出来,让细胞根据信号产生出所需的功能蛋白,可以形象地理解为药物在细胞里用“加法”方式实现治疗效果。但当需要在细胞里做“减法”,消除不希望表达的信号该如何做呢?这就需要借助小干扰RNA(short interfering RNA,siRNA)药物实现基因沉默效应。
1998年,斯坦福大学的 Andrew Fire 和马萨诸塞大学的 Craig Mello 首次发现RNA干扰(RNA interference,RNAi)现象:有些特殊的核酸(如:双链RNA,dsRNA),在细胞内被特定的核糖核酸酶(Dicer)切割成长度为 21~23 个碱基对的小片段(小干扰 RNA),可下调相应蛋白的表达。后来这一发现被认为是让基因沉默(不表达)的机制。这一发现在8年后(2006年)获得了诺贝尔生理学/医学奖。诺贝尔奖委员会在官方发布中的评价是:“RNAi是控制遗传信息流动的根本机制,已在基础科学领域得到了广泛的应用,也将引领人们找到创新的疾病疗法。”
基因沉默的机制是:细胞质内的siRNA 先与一个特定蛋白结合形成 RNA 诱导沉默复合物(RNA-induced silencing complex,RISC),随后siRNA 基于碱基互补配对原则驱动RISC识别并剪切mRNA 中的靶标序列,促进靶 mRNA 被切割或发生降解,进而阻断其后续的翻译和基因功能的表达,最终实现抑制蛋白质的产生。
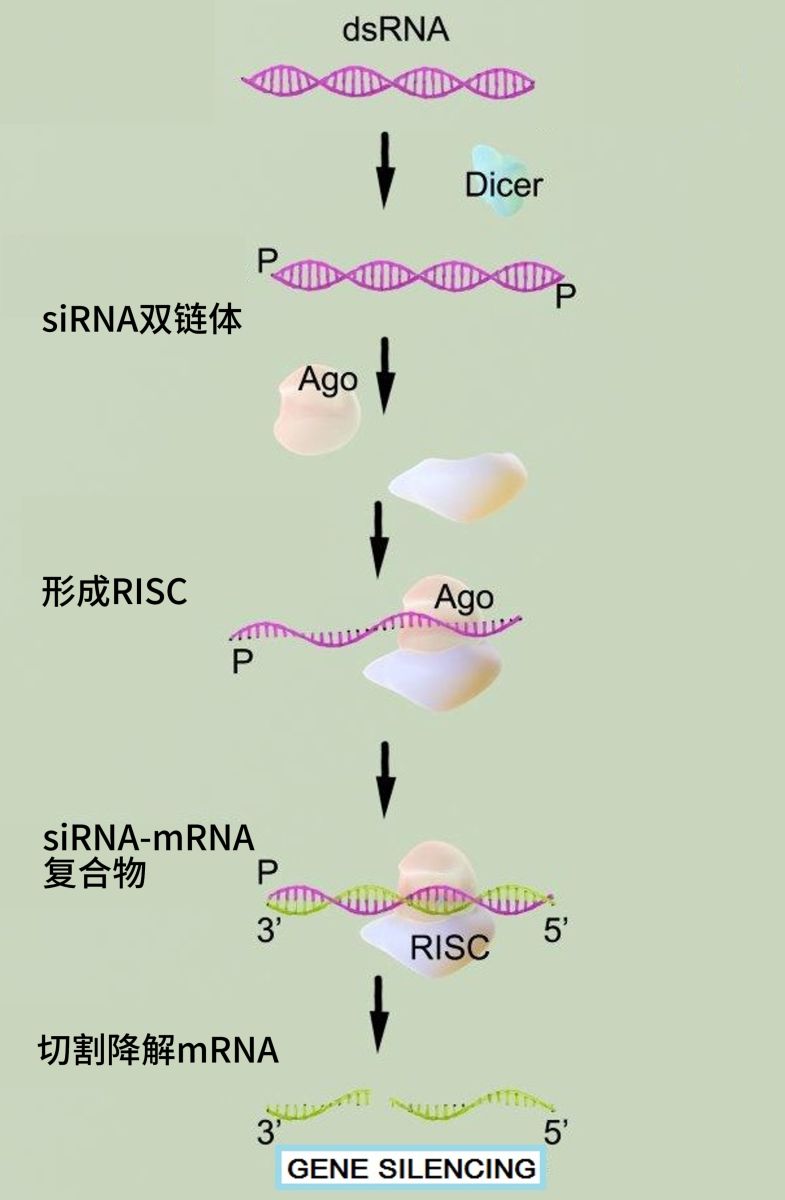
基因沉默机制
由此可以推断,只要能确定导致疾病的蛋白编码mRNA,就可以设计与之匹配的siRNA,通过靶向mRNA的切割和降解,从而阻断错误蛋白的产生,这种siRNA就有可能成为根除此类疾病的药物。然而“理想很丰满”,将siRNA开发成临床可用的药物仍面临诸多复杂的生物学和技术层面的挑战。首先,siRNA 作为一种带有负电荷、分子质量较大的亲水性生物分子,很难直接穿透细胞膜进入细胞内部;其次,siRNA 极易被体内的溶酶体降解并迅速清除;第三,siRNA易被免疫系统识别和攻击,引起免疫反应;第四,siRNA的脱靶效应可能导致一系列非常严重的毒副反应。因此,安全、靶向的药物递送系统是siRNA成药研究的重点和难点。目前成功的递送系统仅有脂质体纳米颗粒(lipid nanoparticle,LNP)和N-乙酰半乳糖胺(GalNAc)偶联修饰两种。
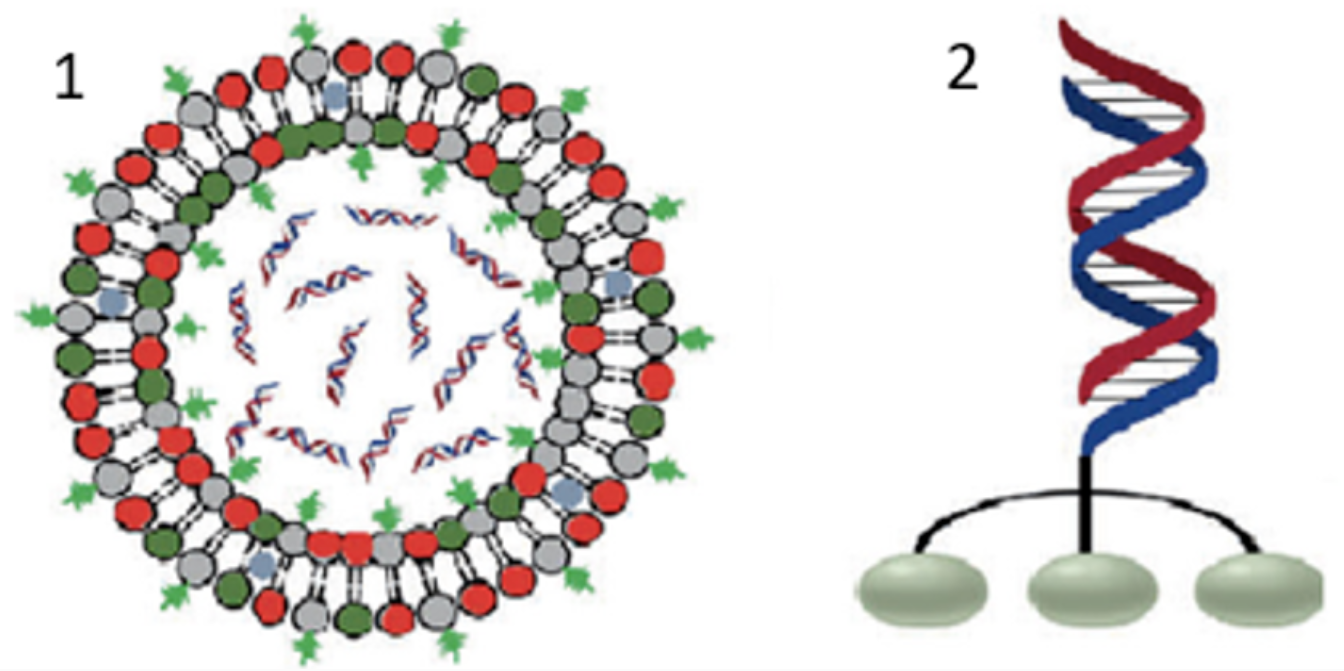
核酸药物递送系统 (1:脂质体递送系统;2:GalNAc 递送系统)
只要成功将siRNA送入靶细胞中,这类核酸药物就可以产生级联放大效应。在RNA 聚合酶(RdRP)的作用下,siRNA 会自扩增产生更多的自己,就好像神话里的孙悟空变出很多具有同样战斗力的徒子徒孙,使少量的 siRNA 产生显著的高效作用。同时,siRNA还可以像催化剂一样被反复回收利用,在促使靶mRNA切割降解后,自身能够被回收并再次发挥作用。在治疗中产生“一对多”的持久的基因沉默作用,因而可显著延长下一次用药时间。
自2018年首款siRNA药物上市以来,目前有6种siRNA药物获批。其中5种用于治疗遗传性疾病(罕见病),另有1种用于治疗慢性病,即广为人知的降脂药英克司兰(Inclisiran商品名:乐可为® Leqvio)。它具有siRNA药物强劲持久效力的共性,“半年打一针,持续降血脂”的效应受到众多患者的拥趸。据其开发者诺华制药公布的2025第一季度财报显示,该药销售额高达2.57亿美元,同比增长了72%。siRNA药物的成功范例,使得该领域的研究日渐活跃,成为投资新的增长点。据报道,2020年至2024年间,行业资助的siRNA临床试验有150多项,年均复合增长率高达79.5%。随着siRNA药物的持续研发探索,这类药物有望为靶向蛋白药物难以治疗的多种疾病提供新的治疗选择。我们可以期待siRNA药物在更多的遗传性疾病、血液病和肿瘤治疗中大放异彩。
主要参考文献:
[1] FDA发布寡核苷酸疗法开发临床药理学考量终版指南“Clinical Pharmacology Considerations for the Developments of Oligonucleotide Therapeutics”。
[2]《体内基因治疗产品药学研究与评价技术指导原则(试行)》的通告(2022年第31号)
[3] 张从一,牧原等. siRNA 药物在肿瘤靶向治疗中的研究进展[J]. 药学进展,2024,48(7):548-560.
[4] Optimizing siRNA Therapeutics: Addressing Nonclinical and Manufacturing Complexities. https://novotech-cro.com/whitepapers/optimizing-sirna-therapeutics-addressing-nonclinical-and-manufacturing-complexities?utm_campaign=PANTHEON_STRIPPED&utm_id=PANTHEON_STRIPPED&utm_medium=PANTHEON_STRIPPED&utm_source=PANTHEON_STRIPPED
图片来源于网络
撰写:如初