引言:癌症治疗的百年困局与一缕破晓之光
当手术刀遭遇深部肿瘤的禁区,当传统放疗的无差别轰炸伤及无辜组织,当化疗药物在全身循环中引发连锁风暴——人类对抗癌症的征途上,精准始终是难以企及的圣杯。然而,一种融合了核物理尖端智慧与生物靶向精妙设计的疗法——硼中子俘获治疗(Boron Neutron Capture Therapy, BNCT),正以“细胞级核导弹”的姿态,为突破这一困局带来革命性的曙光。
一、核心揭秘:BNCT如何实现“细胞级精准爆破”?
BNCT的精髓,在于其巧妙的“两步走”战略,将核反应的巨大能量精确引导至癌细胞内部释放,实现对癌细胞的毁灭性打击,同时最大程度保护周围正常细胞。
第一步:精准递送
“智能弹药”硼-10载体:给患者注射含稳定同位素硼-10 (¹⁰B) 的特殊化合物(硼药剂)。这些化合物如同经过精密设计的“特洛伊木马”,能够借助肿瘤组织特有的生理特性(如旺盛的血供、增大的血管通透性、某些肿瘤的特定分子靶点),相对选择性地富集在癌细胞内部。当前最常用的两种硼药剂是:
- 硼苯丙氨酸 (BPA):模拟氨基酸,易被代谢旺盛的癌细胞摄取。
- 巯基硼烷 (BSH):早期使用,在某些脑瘤中有一定富集。
癌细胞与正常细胞中硼-10浓度的比值 (肿瘤/正常组织摄取比, T/N Ratio) 是BNCT成功的核心前提。理想状态下,硼药剂只在癌细胞中高浓度聚集,而在周围健康细胞中含量极低。研发更高效、更精准的下一代硼药剂是当前热点。
第二步:精准引爆——“中子钥匙”启动核爆
- “点火装置”热中子束:当硼-10在肿瘤部位达到足够浓度后,用一束能量较低的热中子(平均能量约0.025 eV)或超热中子(能量稍高,穿透性更好,在体内慢化为热中子)照射肿瘤区域。
- “核裂变”级杀伤:硼-10原子核具有极高的热中子捕获截面。一旦捕获一个热中子,硼-10核变得极不稳定,瞬间发生核裂变反应:
¹⁰B + n(热) → [¹¹B]* → ⁷Li + ⁴He (α粒子) + 2.79 MeV (能量)
- “细胞杀手”诞生:这个反应产生两个极具破坏性的高线性能量传递 (High-LET) 粒子:α粒子 (⁴He 核):带正电,质量大,在生物组织内射程极短(约5-9微米,仅相当于一个细胞的直径)。能量在极短距离内集中释放。锂离子 (⁷Li): 也带正电,射程略长于α粒子(约5微米),同样具有高LET特性。
- “微爆”效应:这些高LET粒子在产生点(即富集了硼-10的癌细胞内部)附近几微米的极小范围内,释放出巨大能量,对细胞DNA等关键结构造成密集的、难以修复的致死性损伤。由于它们的射程小于细胞直径,其毁灭性作用被严格限制在含有硼-10的单个癌细胞内部及其紧邻区域。周围不含或含极少量硼-10的正常细胞,受到的损伤微乎其微。
核心优势:BNCT精准杀伤的物理与生物学基础
- 双重靶向性:第一重是生物化学靶向(硼药剂在肿瘤细胞的相对选择性富集),第二重是微观物理靶向(高LET粒子的超短射程将能量沉积严格限制在靶细胞内)。这是BNCT实现“细胞级”精准治疗的根本。
- 高LET粒子的生物学优势:与常规放疗(X射线、γ射线)产生的低LET电子不同,α粒子和锂离子造成的DNA损伤更复杂(多为双链断裂),细胞修复难度极大,对乏氧细胞(放疗抵抗的重要原因)同样有效,且杀伤效率不依赖于细胞周期阶段。这意味着癌细胞被“一击必杀”的概率更高。
- 对微环境侵袭性肿瘤的潜力:如弥漫浸润性生长的脑胶质瘤、复发性头颈癌等,传统手段难以根除。BNCT的细胞级杀伤特性,使其在理论上具备清除这些“散兵游勇”癌细胞的能力。
二、源远流长:BNCT的探索之路与关键里程碑
BNCT的理念并非新生事物,其发展历程充满了科学家的智慧、工程的挑战和坚韧的探索。
1.理论奠基 (1930s):1936年,科学家G.L. Locher首次提出利用中子俘获反应进行癌症治疗的概念,奠定了BNCT的理论基石。
2.早期探索与挫折 (1950s-1960s):1951年,美国布鲁克海文国家实验室 (BNL) 的William Sweet团队利用研究堆的热中子束,首次对晚期脑胶质瘤患者进行了BNCT临床试验。早期试验受限于:
- 中子束质量不佳(热中子穿透深度不足,深部肿瘤难以治疗)。
- 硼药剂选择有限且靶向性不理想(如BSH)。
- 缺乏精确的剂量计算和生物效应评估方法。
- 结果不尽如人意,甚至出现严重副作用,导致研发热情一度冷却。
3.技术蛰伏与积累 (1970s-1990s):
- 中子源优化:认识到超热中子的重要性。超热中子能量较高(约1 eV - 10 keV),能更深入地穿透组织(数厘米),在到达肿瘤深部过程中逐渐慢化为热中子。这解决了深部肿瘤的治疗难题。日本京都大学研究堆 (KUR) 等机构在开发超热中子束装置方面取得重要进展。
- 硼药剂突破:BPA的引入(由日本学者Hatanaka推广)显著提高了对脑瘤的靶向性和治疗效果,成为BNCT复兴的关键。
- 剂量学发展:建立了更完善的物理剂量(伽马射线剂量、中子剂量)和生物有效剂量(考虑硼-10分布和不同粒子生物学效应差异)的计算模型,为治疗计划奠定了基础。
4.临床复兴 (1990s-2010s):
日本成为BNCT临床研究的中心。京都大学、大阪大学等机构利用研究堆进行了大量针对恶性脑瘤(尤其胶质母细胞瘤)、头颈癌(尤其复发性)、黑色素瘤等的临床试验,积累了宝贵的经验,证明了BNCT在特定难治性肿瘤中的显著疗效和良好耐受性。
- 关键人物:日本学者如Hiroaki Hatanaka (脑瘤BNCT先驱)、Yutaka Mishima (皮肤黑色素瘤BNCT先驱) 等做出了卓越贡献。
5.加速器源的革命与临床应用落地 (2010s-至今):
- 摆脱反应堆依赖:研究堆虽能提供强中子流,但通常位于偏远的研究机构,运行维护复杂,放射性废物处理麻烦,且难以在医院普及。开发基于粒子加速器的中子源成为必然趋势。
- 技术突破:通过加速质子或氘核轰击铍或锂靶,产生高强度的中子束(主要为超热中子)。关键技术包括高流强、稳定运行的紧凑型加速器、高效靶材冷却系统、中子束整形体设计等。里程碑:日本住友重工(STBA)与京都大学等合作开发的回旋加速器BNCT系统获得突破。2016年,世界首台医用加速器BNCT设备在日本南东北综合医院安装。2020年3月,日本厚生劳动省正式批准STBA的BNCT系统(商品名:NeuCure®)联合Steboronine®(BPA-果糖注射液)用于治疗无法切除的局部晚期或复发性头颈癌。 这是BNCT发展史上划时代的里程碑,标志着其正式成为一种可临床应用的癌症治疗手段。随后,脑瘤适应症也获得批准。
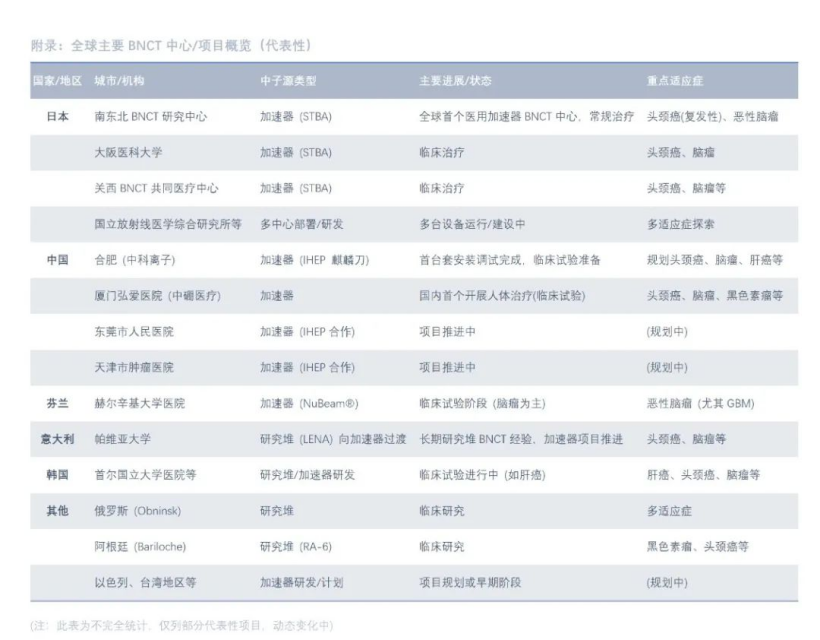
- 全球扩散:日本的成功极大地激发了全球兴趣。芬兰、中国、意大利、韩国、俄罗斯、阿根廷、以色列、美国等都在积极推进基于加速器的BNCT系统研发和临床试验。中国、韩国、台湾地区等也批准了相关设备上市。
三、适应症探索
1.已获批/成熟应用:复发性/局部晚期头颈部鳞状细胞癌(日本)、恶性脑肿瘤(如多形性胶质母细胞瘤GBM,日本)。
2.积极临床试验中:
- 肝癌:尤其对常规放疗不敏感的肝细胞癌和肝内胆管癌,潜力巨大(中、日、韩等国试验中)。
- 恶性胸膜间皮瘤:一种难治性胸部肿瘤(日本、芬兰试验中)。
- 乳腺癌:特别是局部复发或皮肤/胸壁侵犯者。
- 骨与软组织肉瘤:位置复杂或复发者。
- 黑色素瘤:皮肤或粘膜来源。
- 肺癌:局部晚期或胸壁侵犯。
- 胰腺癌:探索性研究。
3.未来潜力:任何具有相对良好硼药剂摄取、位置相对表浅或可通过术中照射覆盖的实体瘤。
四、硼药剂研发
1.当前主力:BPA-果糖(Steboronine®)仍是全球主力,在日本获批。其改良制剂(如提高溶解度、稳定性)在研究中。
2.下一代方向:
- 小分子靶向剂:设计能特异性结合肿瘤细胞表面过表达受体(如叶酸受体、PSMA、EGFR等)的硼化合物,提高靶向性和T/N比。
- 纳米载体:脂质体、聚合物胶束、树枝状大分子、碳硼烷簇等纳米平台,用于包载大量硼原子,增强肿瘤富集(EPR效应或主动靶向),并可能实现药物/基因协同治疗。
- 双/多功能硼药剂:整合诊断(如PET显像)和治疗功能。
3.挑战:高效合成、体内稳定性、安全性、规模化生产、监管审批。
五、技术与流程优化
- 精准剂量学:发展更先进的治疗计划系统 (TPS),整合实时/在线硼浓度监测技术(如瞬发伽马射线分析PGRA),实现真正个体化、自适应治疗。
- 束流品质提升:优化加速器设计、靶系统和束整形体,获得更纯净、通量更高、深度剂量分布更优的中子束。
- 治疗流程标准化:建立从患者筛选、硼药剂输注与监测、体位固定、照射计划制定与验证、治疗实施到随访的规范化流程。
- 设备小型化与成本控制:降低设备造价和运行成本,提高普及性。
六、未来蓝图:BNCT的发展规划与无限可能
BNCT的未来充满希望,但也需克服诸多挑战。其发展路径将围绕几个核心方向:
1.拓展适应症:
- 深度挖掘现有潜力领域:积累更多肝癌、恶性胸膜间皮瘤、肉瘤、乳腺癌等的临床数据,争取获批新适应症。
- 探索新战场:深入研究胰腺癌、肺癌(尤其局部晚期)、前列腺癌、妇科肿瘤等的可行性和疗效.
- 术中BNCT (IO-BNCT):在手术切除肿瘤后,对瘤床进行直接照射,杀灭残留的、肉眼不可见的癌细胞,尤其适用于脑瘤、头颈癌、腹膜后肿瘤等。这需要开发小型化、便携式中子源或特殊照射装置。
2.革命性硼药剂:
- 实现“智能寻的”:开发具有明确肿瘤分子靶点(如HER2, PSMA, EGFR突变体等)的高亲和力、高载硼量小分子或纳米载体,将T/N比提升至10:1甚至更高,显著提高疗效并降低对正常组织的潜在影响。
- “诊疗一体”:研发整合PET/SPECT显像基团的硼化合物,实现无创、实时监测肿瘤硼分布,指导精准照射。
- “协同作战”:设计硼载体同时搭载化疗药物、免疫调节剂或放疗增敏剂,实现BNCT与化疗、免疫治疗的协同增效。
3.技术精进与智能化:
- 在线监测与自适应:集成PGRA等实时硼浓度监测技术,结合人工智能(AI),使治疗计划系统能在照射过程中根据实际硼分布动态调整照射参数,实现真正的“自适应放疗”。
- 束流优化无止境:研发更高流强、更稳定、更紧凑、束流品质更优(如更高比例超热中子、更低快中子和伽马污染)的加速器中子源。
- 剂量计算更精准:发展基于先进蒙特卡洛模拟和患者个体化影像的微观剂量计算方法,更精确评估生物有效剂量。
七、挑战与思考:迈向未来的荆棘之路
尽管前景光明,BNCT仍需正视并跨越以下障碍:
- 硼药剂靶向性的终极挑战:如何设计出对所有肿瘤、所有患者都高效特异的“完美”硼载体?肿瘤异质性和微环境复杂性是巨大障碍。
- 复杂精准的剂量学:BNCT剂量计算涉及物理剂量(中子、伽马)和生物有效剂量(依赖硼浓度分布),极其复杂且存在不确定性。实时监测技术的普及和准确性至关重要。
- 高昂的初始投入:加速器BNCT系统造价动辄数千万至上亿元人民币,建设和运营成本高昂,限制了其在基层的普及。如何降低成本是产业化的核心课题。
- 专业人才稀缺:BNCT是高度交叉学科,需要精通核物理、放射生物学、医学物理、放射肿瘤学、核工程等多领域的复合型人才。全球范围内都存在人才缺口,培养体系需完善。
- 长期疗效与副作用的全面评估:作为一种相对新兴的治疗手段,其长期生存获益、晚期副作用(尤其是继发恶性肿瘤风险,尽管理论上高LET辐射致癌性可能低于低LET辐射)需要更长时间的随访和大样本数据来确认。
- 监管路径:各国药监机构对BNCT设备(作为组合产品:设备+药物)和新型硼药剂的审批路径仍在探索和完善中。高昂的费用如何获得医保或保险覆盖是影响患者可及性的现实问题。
- 公众认知与接受度:“中子”、“核反应”等词汇可能引发公众对辐射安全的疑虑。科学普及和透明沟通非常重要。
结语:精准抗癌的“明日之星”,照亮希望之路
硼中子俘获治疗(BNCT),这项诞生于核物理实验室的智慧结晶,历经八十余载的曲折探索,终于凭借其“细胞级核导弹”般的精准杀伤理念,从梦想走进现实,成为对抗癌症武器库中一颗冉冉升起的“明日之星”。它在复发性头颈癌、恶性脑瘤等传统疗法束手无策的领域展现的曙光,以及在肝癌、肉瘤等更多难治性肿瘤中蕴藏的巨大潜力,为无数患者点燃了新的希望。BNCT不仅仅是一种疗法,它更代表着人类追求癌症治疗终极目标——精准清除每一个癌细胞而不伤及无辜的执着信念和不懈努力。它正在并将继续重塑肿瘤放疗的格局,为精准抗癌的宏伟篇章写下浓墨重彩的一笔。让我们共同期待,这颗“明日之星”愈发璀璨,照亮更多生命的前行之路。
撰写:芦鑫淼
审核:秦维伟


