2025-11-05
有临来雅

临床试验数据审核会(Data Review Meeting)是临床试验质量管理的核心环节,是一个多学科协作、以数据为驱动的决策过程。它并非一次性的讨论会,而是贯穿整个临床试验周期、确保数据高质量与可靠性的系列闭环管理活动。
一、DRM的核心价值与目标
DRM的根本目的是确保用于申报和发表的试验数据是可靠、完整和可信的。
它直接服务于三大支柱:
其法规基础源于ICH E6 (R2) GCP中关于“建立质量管理体系”和“基于风险的质量管理”的强制性原则。虽然无单一文件明文规定“必须召开DRM”,但它是申办方履行其质量职责的行业标准与最佳实践,是监管核查中证明其数据可靠性的关键证据。
二、DRM的流程
DRM的成功依赖于一个结构化的“会前-会中-会后”循环。
1.会前准备是成功的基石,占70%的工作量
数据管理项目经理与项目经理协作会议讨论内容,并发出会前邮件,通知数据管理,医学,统计师,申办者,研究者参会,可按需要准备会前材料。
由数据管理/统计团队准备核心材料,其关键是“数据清单”——将海量数据中需人工判断的特定问题点筛选出来,集中讨论(详见第四部分)。
数据管理项目经理提前将议程、数据清单和报告分发给所有参会人(医学,统计师,申办者,研究者),确保会前充分审阅,如参会人审核后需要更新数据,则可以在会前更新材料。
2.会中执行
3.会后跟进
三、关注重点:围绕数据质量、安全与科学性的审核维度
1.数据质量与完整性
数据审核会之前数据及时录入,无缺失,与源数据一致且无逻辑问题,准确无误,且与外部数据核查的一致性通过。数据管理内部质控结果通过,并向项目组汇报质控报告。
2.受试者安全与伦理学
3. 方案符合性与试验科学性
四、核心工具:“数据清单”的具体示例
数据清单是DRM的“作战地图”,它将抽象的数据问题具体化。以下为具体示例:
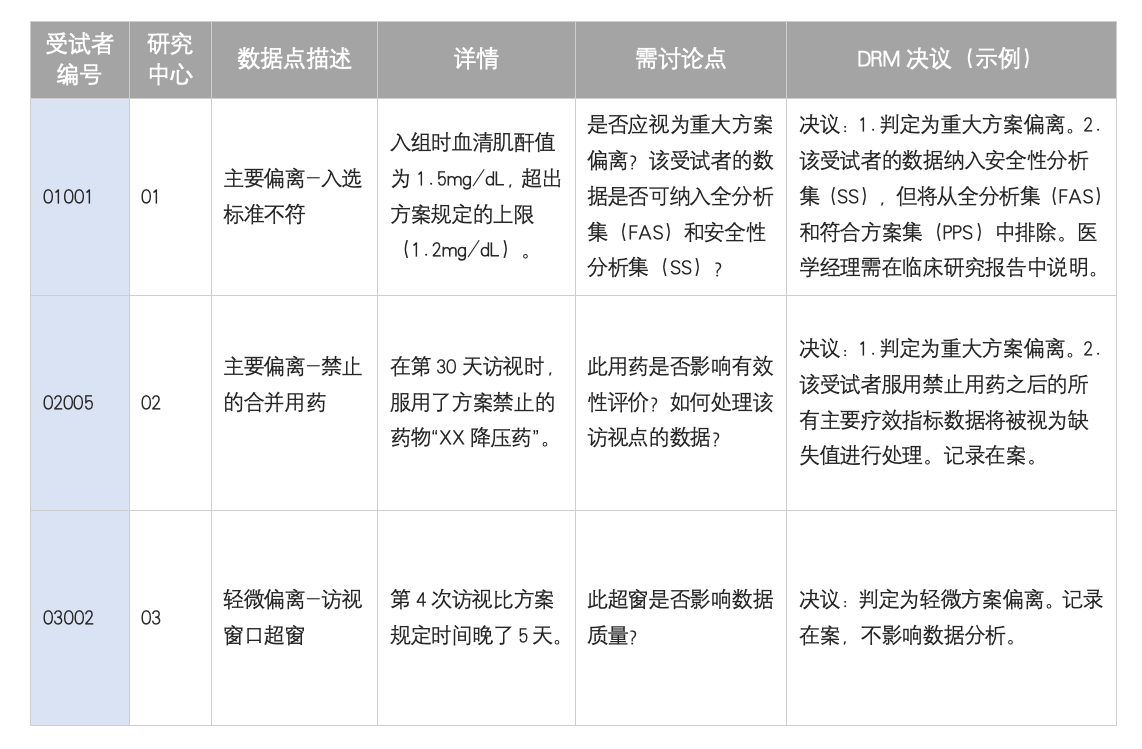
目的:审核所有未严格遵循试验方案的情况,并决定其对试验数据有效性的影响。
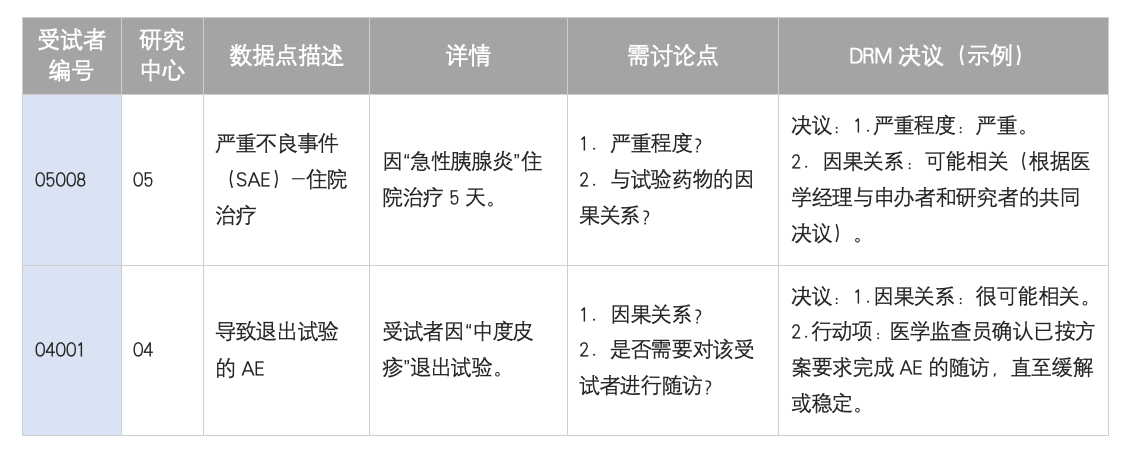
目的:集中审核严重、特殊的AE,确保受试者安全与正确记录。
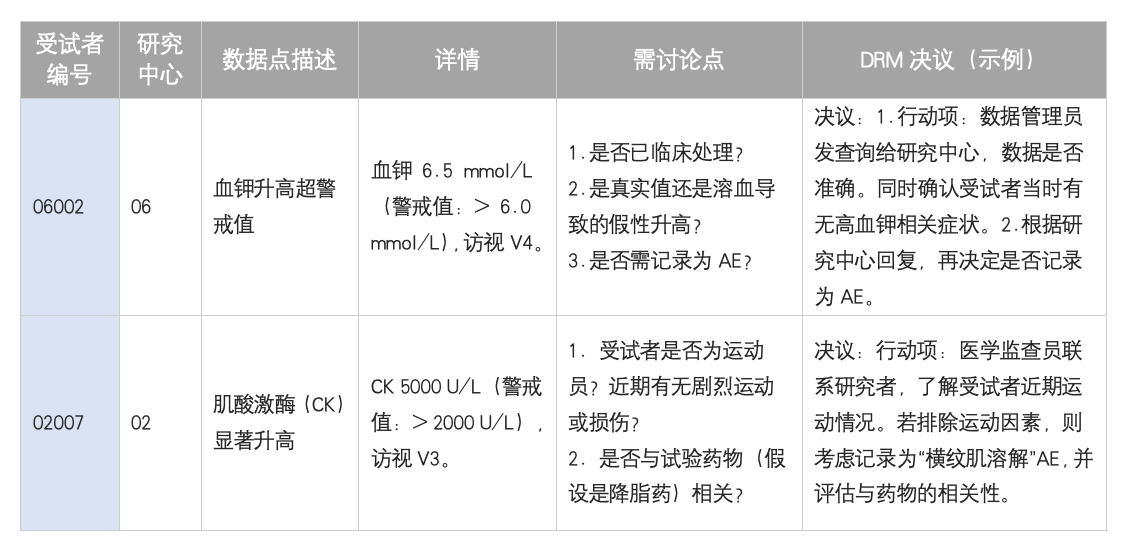
目的:识别和评估有潜在安全风险的实验室检查值,并决定后续行动。
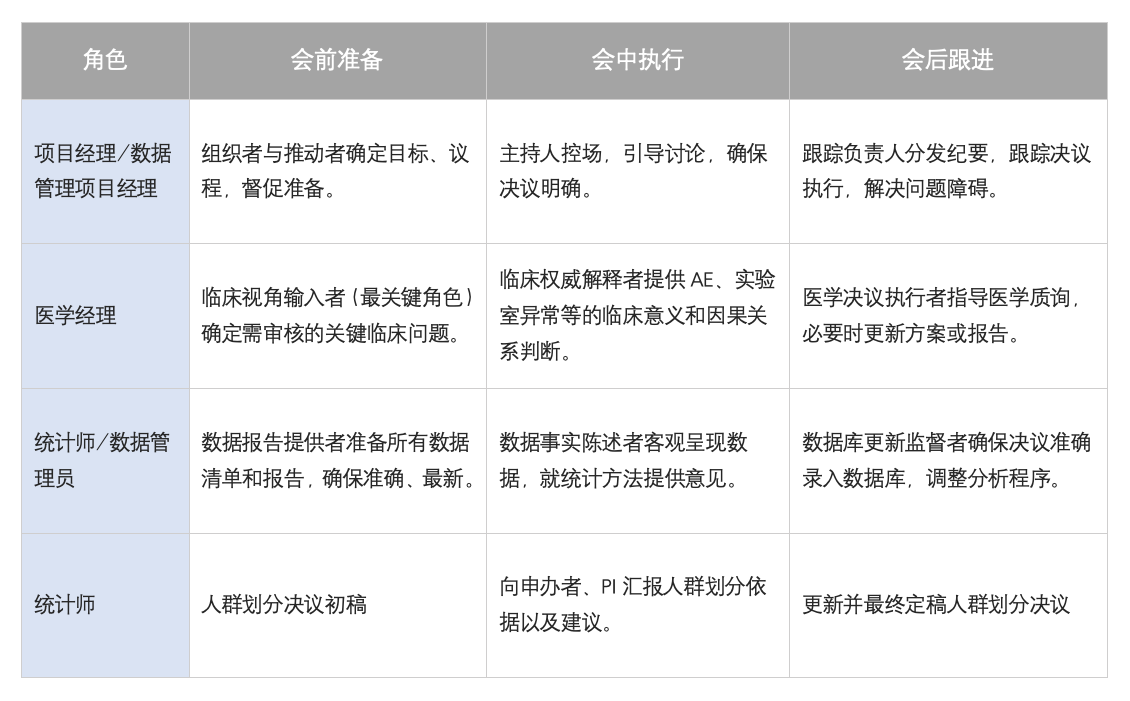
五、核心角色的职责分工:三位一体的协作
临床试验数据审核会是现代临床试验质量管理的支柱。通过系统化的流程、聚焦重点的审核、基于数据清单的高效讨论以及明确的角色分工,DRM能有效地将数据风险转化为可控行动,最终确保试验数据的可靠性,为药品的安全有效评价奠定坚实基石。
撰写:张建芳
审核:章飞燕