2025-04-28
有临医药

自身免疫疾病是一类由免疫系统异常攻击自身组织引起的慢性炎症性疾病,包括类风湿关节炎、系统性红斑狼疮、炎症性肠病、多发性硬化症等【1】。随着对疾病发病机制的深入理解,临床药理学在自身免疫疾病治疗中的作用日益凸显。自身免疫疾病的发病机制涉及免疫系统对自身组织的异常攻击,其药物研发靶点广泛,涵盖细胞因子、免疫细胞表面分子、信号通路等。目前主流药物类型包括:生物制剂:如TNF-α单抗(阿达木单抗)、IL-6R拮抗剂(托珠单抗)、IL-17/IL-23抑制剂(司库奇尤单抗、乌司奴单抗);小分子靶向药:如JAK抑制剂(托法替布、乌帕替尼)、BTK抑制剂(奥布替尼)等。本文将简单介绍自身免疫药物在临床药理中的研究策略。
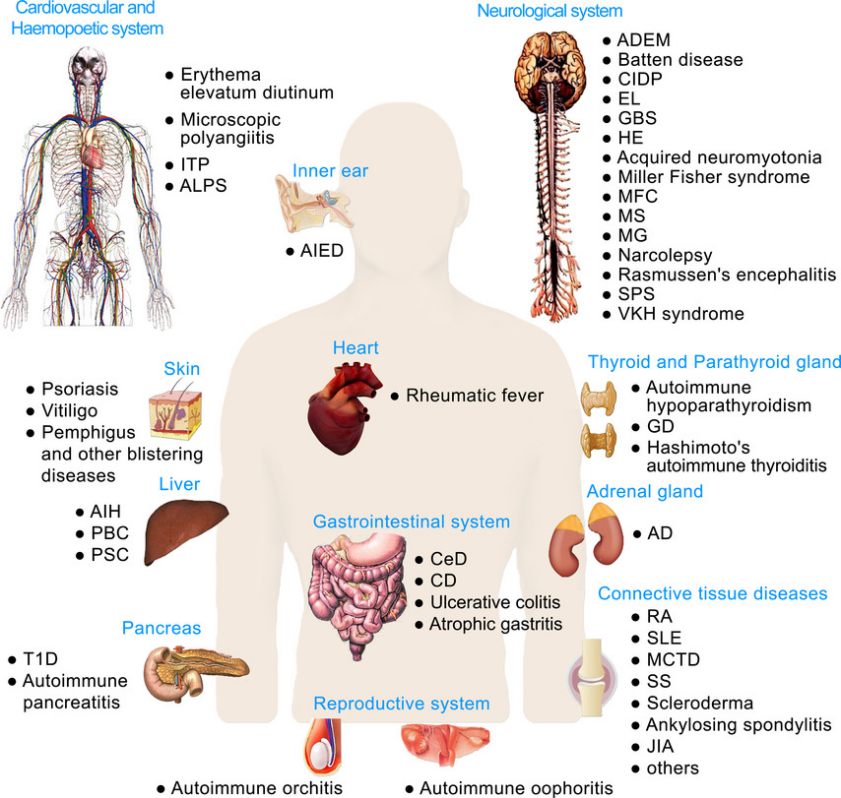
图1 代表性的器官特异性和系统性自身免疫性疾病【1】
自免药物需在早期阶段分别开展健康受试者和患者的临床药代动力学(PK)研究,自免药物的PK特点因其分子类型(如生物制剂或小分子靶向药)和作用机制不同而存在显著差异。生物制剂(如单抗、融合蛋白):通常通过皮下注射(SC)或静脉注射(IV)给药,避免胃肠道降解。生物制剂的生物利用度较高(皮下注射约60%-80%),但可能受注射部位、患者免疫状态(如抗药物抗体)影响。而小分子靶向药(如JAK抑制剂、甲氨蝶呤),口服吸收受食物、胃肠道pH及首过效应影响,个体差异较大。生物制剂由于分子量大(约150 kDa),主要分布于血液和细胞外液,难以穿透细胞膜,分布容积(Vd)较小(与血浆容积接近,约3-5 L)。而小分子药物在细胞内分布广泛,可进入细胞内,Vd较大(如甲氨蝶呤Vd约0.4-0.8 L/kg)。生物制剂(如单抗)通常经蛋白酶降解或靶点介导的清除(如与靶点结合后被内吞分解),通常不进行单独的肝肾功能研究,但对于ADC类药物,仍需关注其小分子载荷在肝肾功能异常时的蓄积风险。而小分子靶向药物常经肝脏代谢(CYP450酶),肾脏或胆汁排泄,应尽早评估肝/肾功能不全对药物PK的影响。如环孢霉素和他克莫司在肾功能患者使用时,需调整剂量或监测血药浓度,以避免毒性【2】。明确自免药物在人体内药代动力学特征,能指导临床更有效地使用药物而减少毒副作用。
自身免疫药物的药效动力学研究聚焦于药物与免疫系统的相互作用机制、疗效的动态变化以及安全性特征。其核心在于通过精准调控免疫反应,平衡治疗效果与潜在风险。如度普利尤单抗能选择性抑制IL-4和IL-13的关键信号通路,阻断Th2型炎症通路。在度普利尤单抗临床研究中,对IL-4和IL-13进行检测,研究数据显示,在度普利尤单抗治疗期间,血浆中IL-4和IL-13均有升高,可能由于度普利尤单抗阻断IL-4Rα导致两种细胞因子清除率降低所致【3】。诺华的司库奇优单抗(Secukinumab)是靶向IL-17A的全人源的单克隆IgG1/κ抗体,可以选择性结合IL-17A,抑制其与IL-17受体(IL-17R)的相互作用及相关促炎信号通路的激活。临床试验中,研究人员通过选择IL-17A、IL-17F、human beta-defensin-2(hBD-2)作为生物标志物,在mRNA、蛋白和组织中对这三个生物标志物进行了表达测定,从而来评估其药理药效【4】。C反应蛋白(CRP)是一种急性炎症时相反应蛋白,当机体有急性炎症、创伤和梗塞时,此蛋白会明显升高。研究发现,约98%的类风湿关节炎活动期患者的C反应蛋白会升高,约92%缓解期患者的C反应蛋白显示正常,可作为关节炎活动判断的重要指标。托珠单抗研究通过检测C-反应蛋白(生物标志物)来评估疗效,托珠单抗治疗的患者全身炎症明显减轻:与安慰剂组相比,24h时,托珠单抗组的C-反应蛋白和白细胞水平均明显降低【5】。
抗药抗体可能降低药物暴露,需在生物制剂药物(如单抗、双抗、ADC等)研究中进行监测,开发高灵敏度的免疫原性分析方法(如桥接ELISA),评估ADA发生率、滴度及中和活性。ADA可能影响药物清除(如加速抗体降解)或疗效(如中和药物活性),需分析其对PK/PD的干扰。结合ADA数据与安全性/有效性结果,明确免疫原性的临床意义。如阿达木单抗的临床研究表明临床疗效与谷浓度和C反应蛋白(CRP)水平显著相关【6】,但抗药抗体阳性受试者(ADA阳性率12-17%)的治疗效果较差,他们的药物谷浓度下降,缓解率显著降低。这些结果强调了ADA监测的重要性。
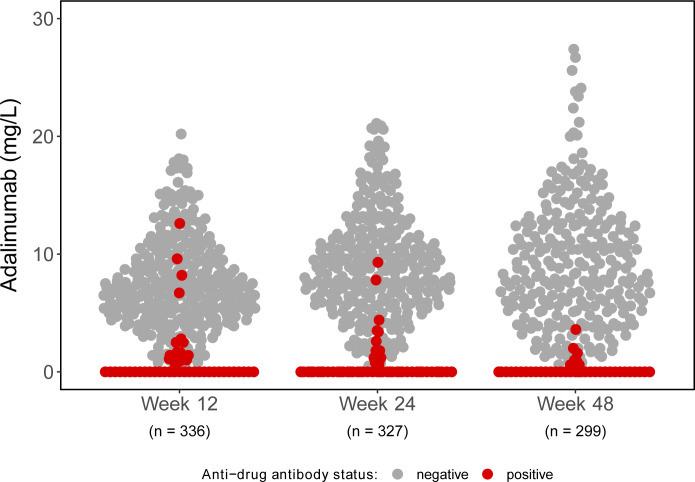
图2 阿达木单抗在第12、24和48周的谷水平分布,其中红点代表抗药抗体阳性的患者【6】
儿科、老年及妊娠/哺乳期人群需针对性研究。由于儿科人群的特殊性,需兼顾科学性和伦理性,在获得PK数据时应遵循风险最小化和痛苦最小化原则,群体药动学(popPK)是儿科人群开展研究常推荐的方法。儿科人群PK参数的个体差异可能较成人更显著,所以在儿科患者中开展的PK研究对临床个体化用药的指导更有实践意义。老年群体需评估多病共存及多药联用风险。妊娠期则需通过胎盘转运研究(如FcRn介导的抗体转移)评估胎儿暴露。
自免药物需结合药物特性决定是否开展DDI研究。比如自免药物中小分子靶向药可能受代谢酶、转运体等影响较大,需通过体外代谢酶/转运体抑制/诱导实验(如CYP450、P-gp)预测临床DDI风险;而对于生物制剂,自身通常不以CYP酶介导的代谢或转运体介导的转运作为其消除途径,受小分子药物的影响较小,但生物制剂如促炎细胞因子或细胞因子调节剂等可能会不同程度影响CYP酶和(或)药物转运体的表达和稳定性。
随着对自身免疫疾病机制的深入理解,这一领域的药物开发取得了显著进展。目前,除了小分子靶向药、生物制剂,核酸药物、细胞疗法、新型双抗等技术形式已进入自免赛道。自免药物临床药理开发思路需基于其作用机制及药物特性,结合多维度研究策略,确保药物安全性与有效性,在研发早期鼓励同步开展药代,相关生物标志物等药效学指标研究,同时观察临床疗效指标,建立药物剂量-暴露-效应关系,考察其关键影响因素,既可为后期临床试验剂量选择提供支持,也可对药物作用机制提供佐证。
参考文献:
[1] Wang L, Wang FS, Gershwin ME. Human autoimmune diseases: a comprehensive update. J Intern Med. 2015 Oct; 278(4):369-95.doi: 10.1111/joim.12395. Epub 2015 Jul 25. PMID: 26212387.
[2] Lee J, Wang R, Yang Y, Lu X, Zhang X, Wang L, Lou Y. The Effect of ABCB1 C3435T Polymorphism on Cyclosporine Dose Requirements in Kidney Transplant Recipients: A Meta-Analysis. Basic Clin Pharmacol Toxicol. 2015 Aug;117(2):117-25. doi: 10.1111/bcpt.12371. Epub 2015 Jan 21. PMID: 25536375.
[3] Blauvelt A, Guttman-Yassky E, Paller AS, Simpson EL, Cork MJ, Weisman J, Browning J, Soong W, Sun X, Chen Z, Kosloski MP, Kamal MA, Delevry D, Chuang CC, O'Malley JT, Bansal A. Long-Term Efficacy and Safety of Dupilumab in Adolescents with Moderate-to-Severe Atopic Dermatitis: Results Through Week 52 from a Phase III Open-Label Extension Trial (LIBERTY AD PED-OLE). Am J Clin Dermatol. 2022 May;23(3):365-383. doi: 10.1007/s40257-022-00683-2. Epub 2022 May 14. PMID: 35567671; PMCID: PMC9142443.
[4] Clinical Pharmacology and Biopharmaceutics Review,FDA,2019. https://www.accessdata.fda.gov/drugsatfda_docs/nda/2019/761081Orig1s000ClinPharmR.pdf
[5] Meyer MAS, Wiberg S, Grand J, Meyer ASP, Obling LER, Frydland M, Thomsen JH, Josiassen J, Møller JE, Kjaergaard J, Hassager C. Treatment Effects of Interleukin-6 Receptor Antibodies for Modulating the Systemic Inflammatory Response After Out-of-Hospital Cardiac Arrest (The IMICA Trial): A Double-Blinded, Placebo-Controlled, Single-Center, Randomized, Clinical Trial. Circulation. 2021 May 11;143(19):1841-1851. doi: 10.1161/CIRCULATIONAHA.120.053318. Epub 2021 Mar 22. PMID: 33745292; PMCID: PMC8104015.
[6] Gehin JE, Klaasen RA, Klami Kristianslund E, Jyssum I, Sexton J, Warren DJ, Aletaha D, Haavardsholm EA, Syversen SW, Goll GL, Bolstad N. Therapeutic serum level for adalimumab in rheumatoid arthritis: explorative analyses of data from a randomised phase III trial. RMD Open. 2024 Nov 13;10(4):e004888. doi: 10.1136/rmdopen-2024-004888. PMID: 39537558; PMCID: PMC11575345.
撰写:谢珊珊
审核:徐兰芳、韩海雄