2025-08-27
有临医药

临床药理学研究是创新药上市前临床研究不可缺失的一环。其研究设计应基于整体研发策略,在研发的关键时间点上,结合临床研究的整体进度进行科学规划和考量。临床药理学研究结果是支持探索性与确证性临床研究设计、以及申报上市的核心科学依据。其结果不仅是新药上市申请资料中的关键组成部分,也为药品说明书的撰写提供了直接支持。
一、临床药理学内容
临床药理学是研究药物在人体内作用规律和人体与药物间相互作用过程的交叉学科,以药理学和临床医学为基础,阐述药物代谢动力学(简称药动学,PK)、药物效应动力学(简称药效学,PD)、不良反应的性质和机制及药物相互作用规律等。

二、临床药理学研究目的
通过采用PK、PD等,探索和优化临床试验中的剂量,支持最终上市剂量。
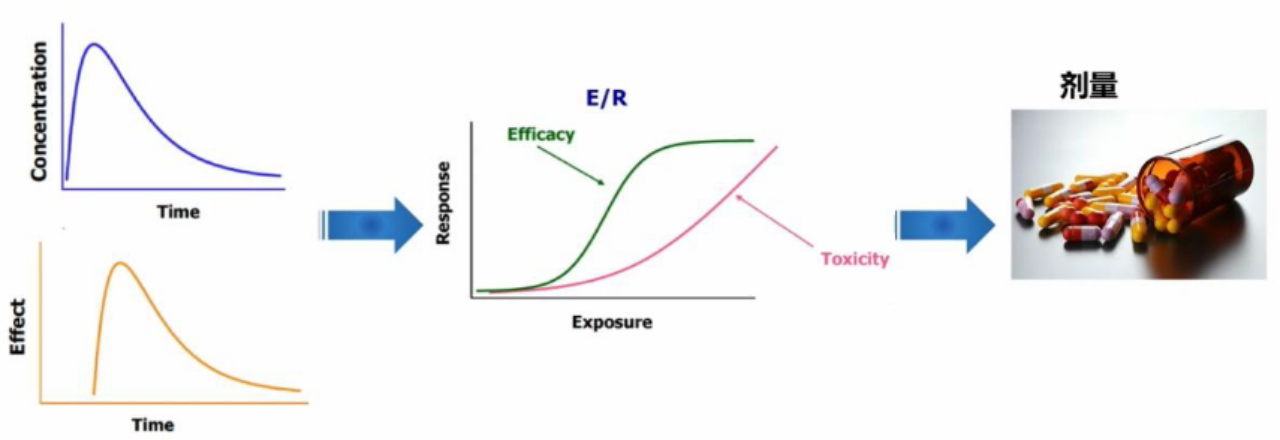
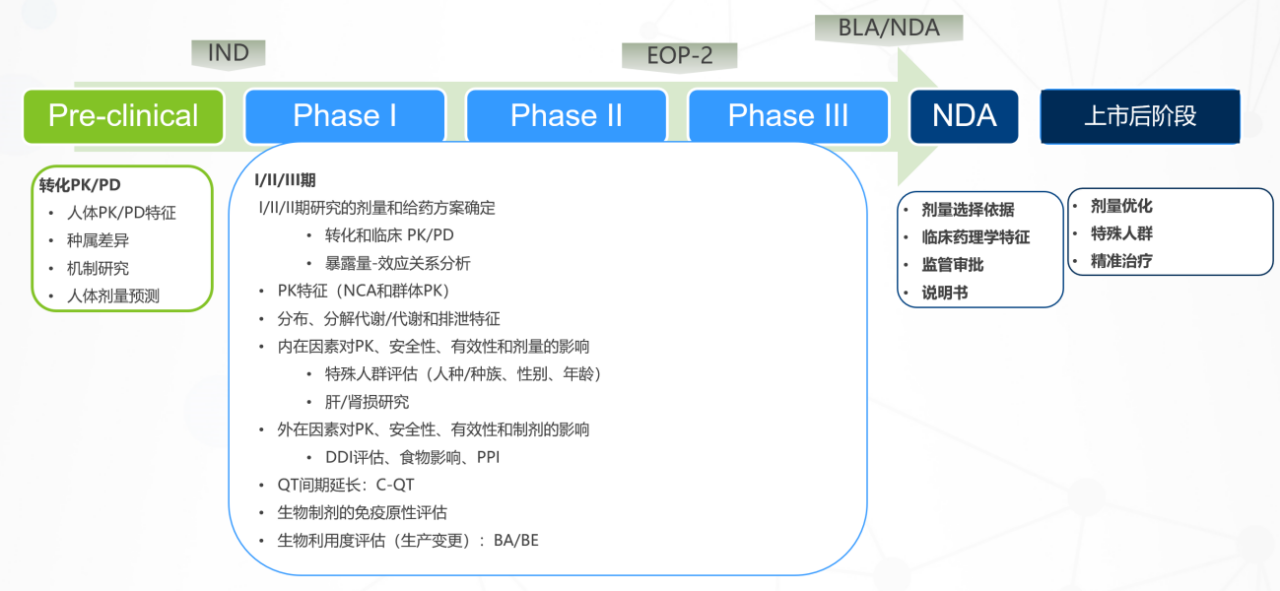
三、临床药理学研究范围—贯穿药物研发全过程
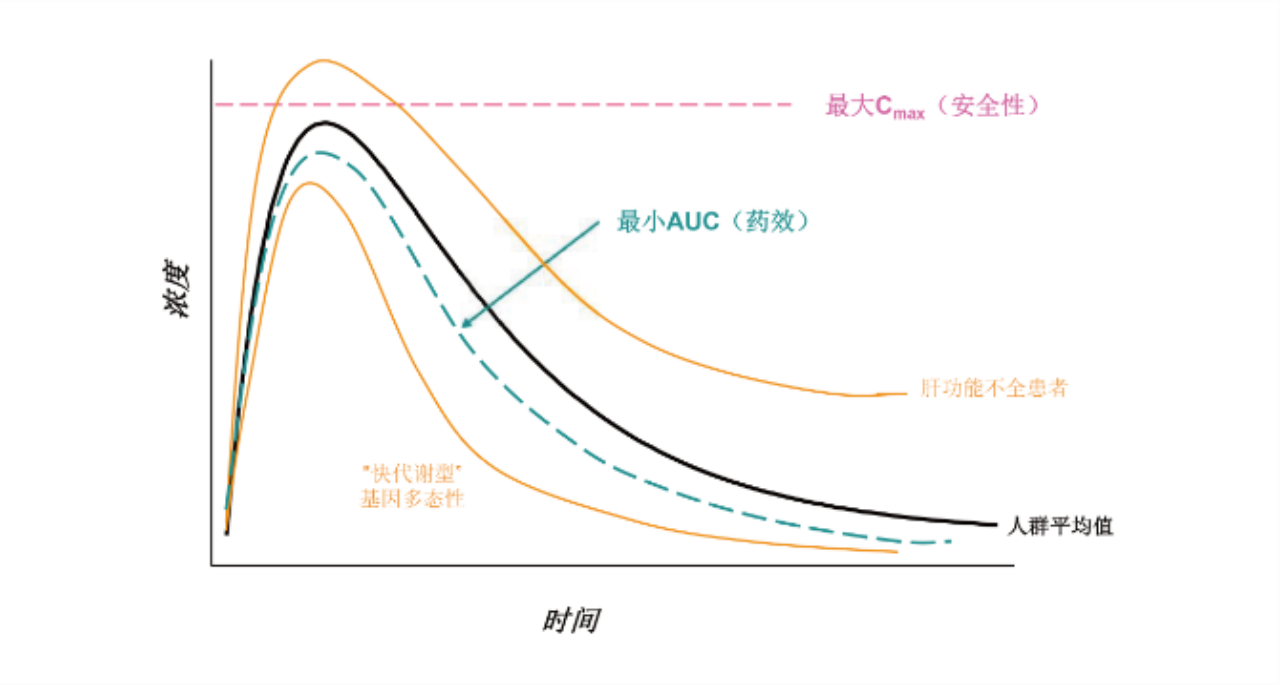
四、临床药理学研究最终目标
指导临床合理用药,在所有相关人群中实现合适的给药剂量/方案
五、如何实现上述目标
结合药物开发策略尽早制定科学合理的临床药理开发计划(Case by Case)
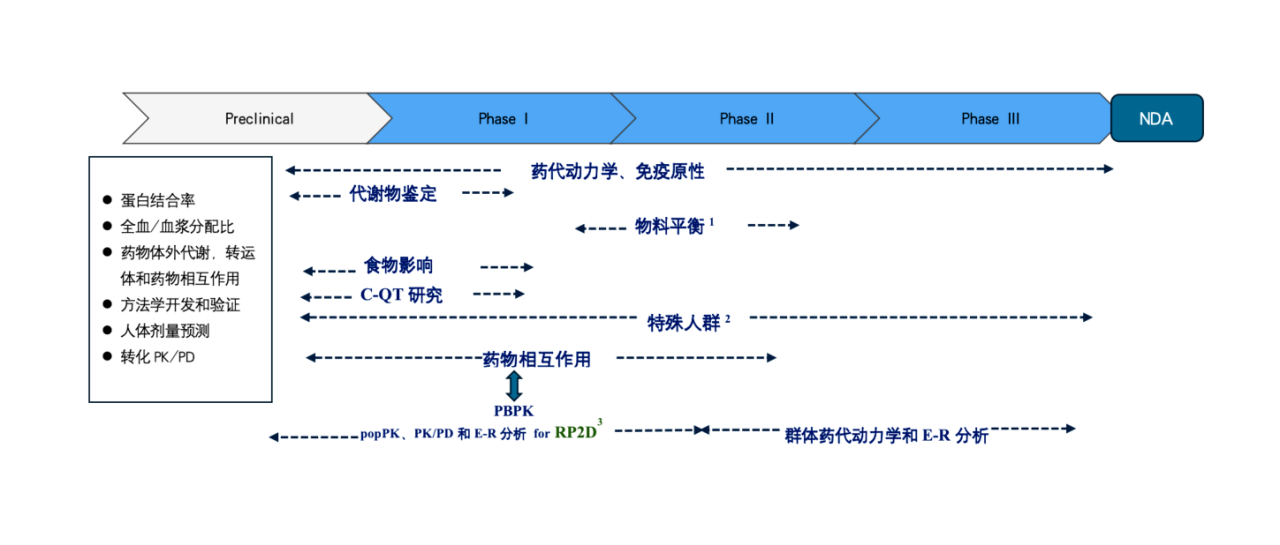
1.FIH进行了代谢物鉴定,如果可以说明药物排泄率回收比例高,可以和监管机构沟通考虑豁免完整的物料平衡试验;
2.对于特殊人群中,如果I期、II-III期中有肝肾功能不全的受试者入组,可以通过popPK分析肝肾功能不全患者的PK暴露差异,和监管机构沟通有豁免肝肾功能不全研究的可能性;
3.RP2D 根据FDA要求,有可能需要Optimize Dose。
六、临床药理学具体研究
单次给药剂量递增(SAD)研究和多次给药剂量递增(MAD)研究,通常包含安全耐受性评价和PK评价等。其中,单次/多次给药剂量递增PK研究是最早探索创新药人体内PK特征并关联暴露量与药物安全性(有时包含药效)关系的研究,可结合在耐受性研究中开展。

患者PK研究,主要研究药物在目标适应症人群中的PK特征,以及患者与健康志愿者(如有)的PK差异。患者PK研究结果为以患者为受试者的探索性和确证性临床研究提供设计依据。患者PK研究有时是独立研究,有时嵌套在评估患者疗效和安全性的探索性和确证性临床研究中。

物质平衡研究,是考察创新药在人体内的吸收、代谢和排泄特征,以阐明原型药及其代谢产物在人体内代谢/消除的途径和时间过程等问题,其对全面认知创新药的临床用药安全有效性结果具有重要意义。物质平衡研究结果对药物相互作用研究和探索性/确证性临床研究设计具有重要参考作用,对肝/肾功能不全人群研究的必要性提供依据。

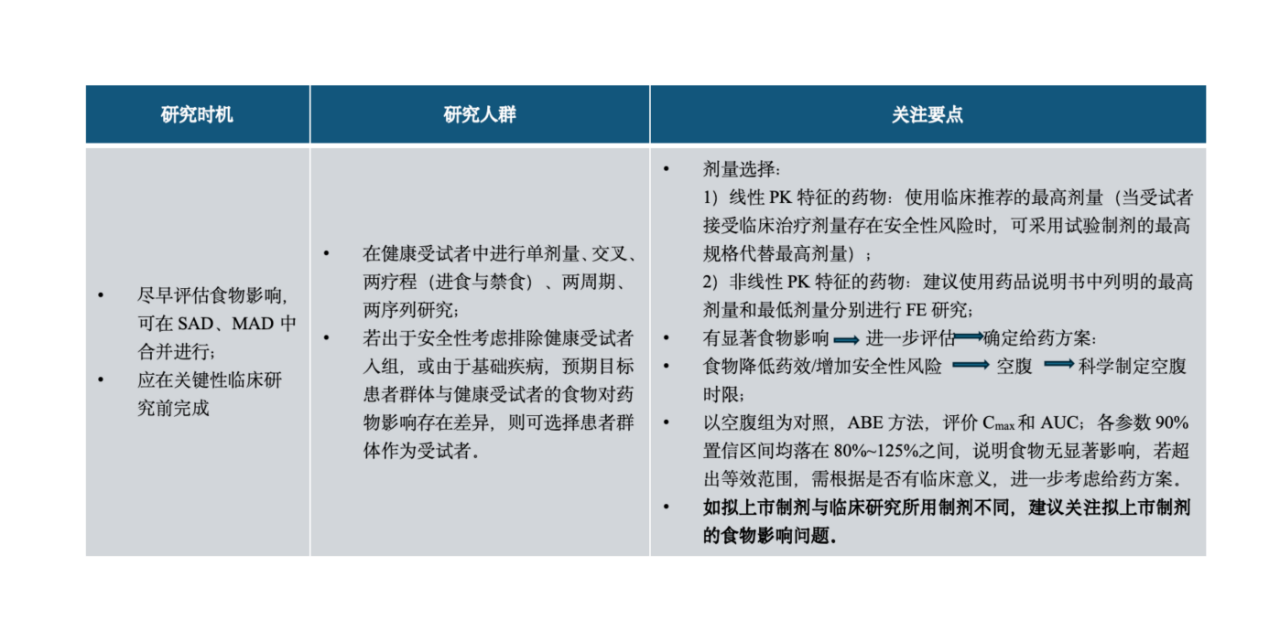
食物影响,研究考察的是与不进餐相比,受试者进餐后创新药体内暴露的变化,以及不同类型的饮食对暴露的影响。食物影响研究结果可用以支持后续临床研究中受试者服药和饮食类型或时间的设计安排,并最终用以指导撰写说明书。
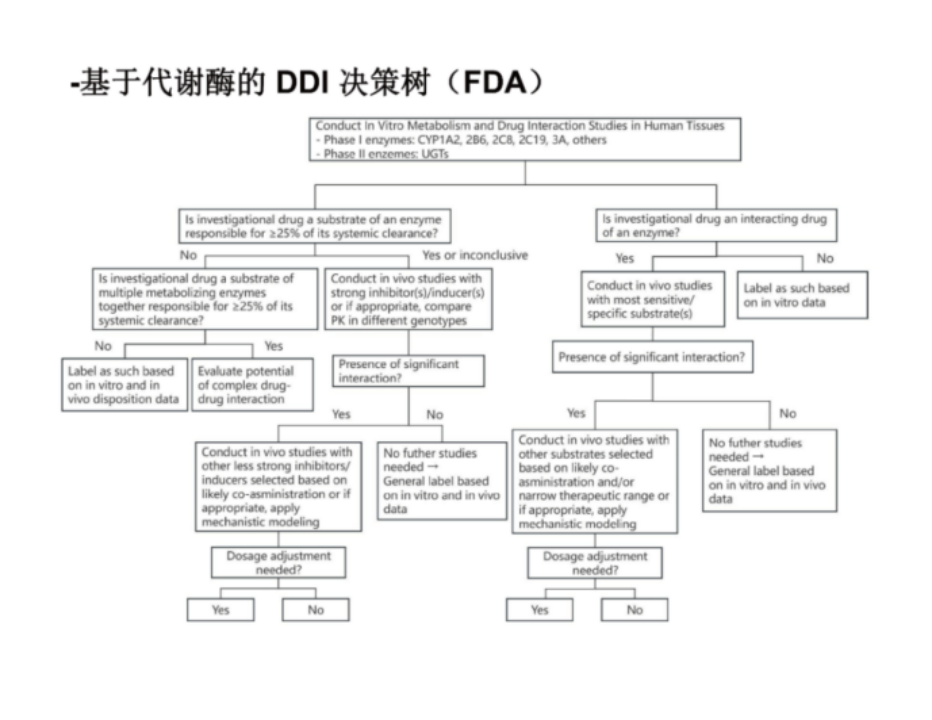
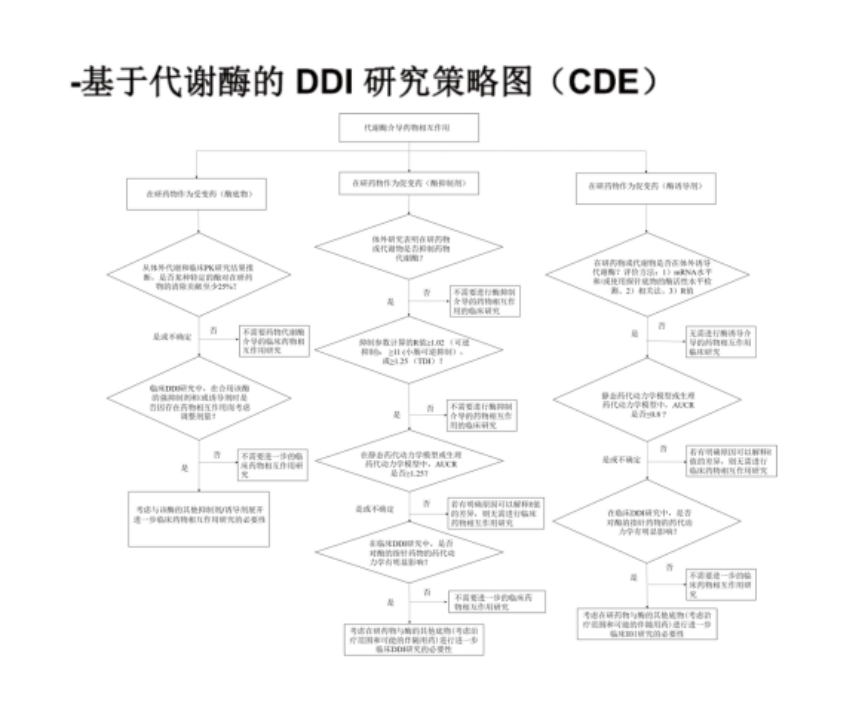
对创新药确定的和可能的产生药物相互作用的因素如代谢酶、转运体等开展临床药物相互作用(DDI)研究,研究结果将指导后续临床研究入排标准、联合用药、剂量调整等设计问题,并将作为说明书中相关内容的撰写依据。

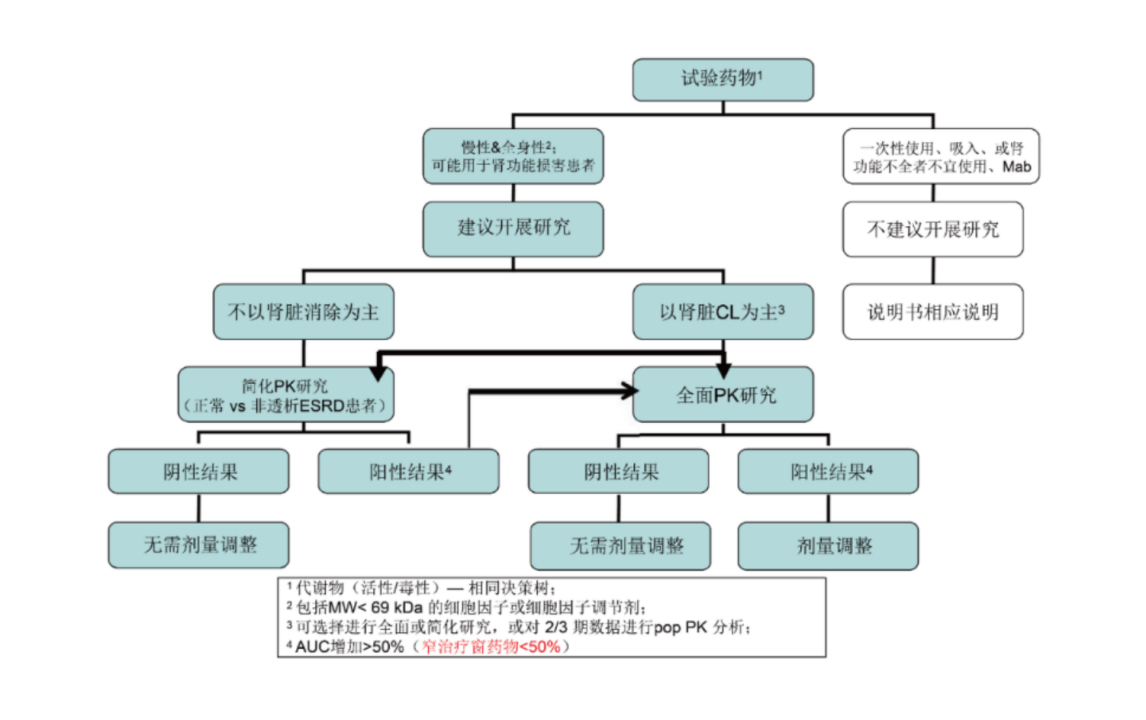
拟开发适应症人群包含肝脏和/或肾脏功能不全患者时应考虑开展相关患者人群的PK研究。建议在创新药临床研发过程中评估肝/肾功能不全对药物PK的影响,以使肝/肾功能不全患者可以考虑被纳入后续临床研究中。肝脏和肾脏作为两大最重要的药物代谢和排泄途径,对多数创新药物尤其是化学药物的PK都可能产生有临床意义的影响。肝功能或肾功能不全的患者对一些创新药体内暴露量可能有一定程度的影响,从而可能影响临床用药安全有效性。
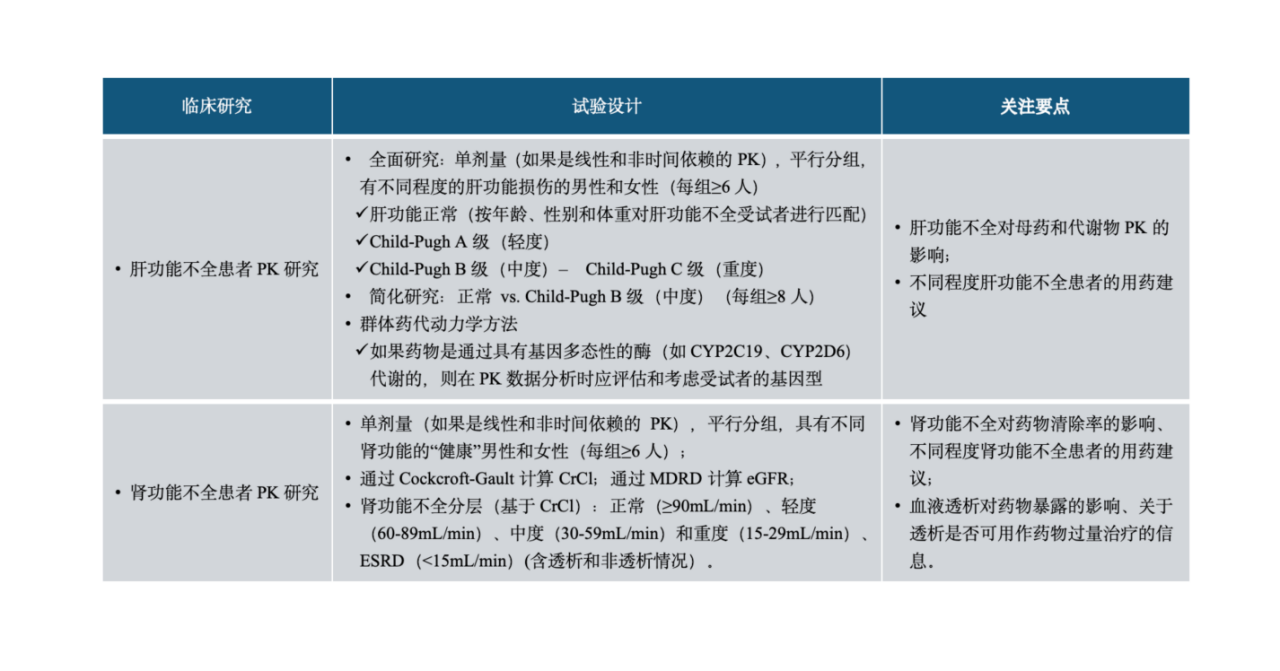
肝功能不全研究:决策树
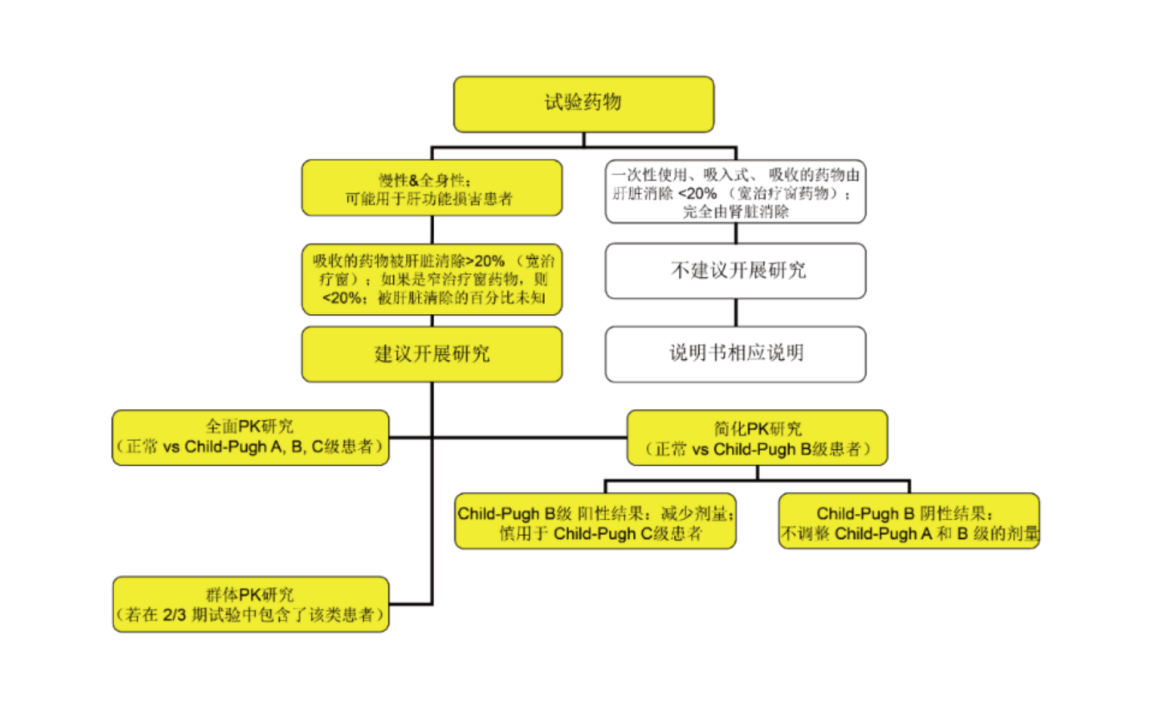
肾功能不全研究:决策树
在创新药临床研究早期阶段,可能通过相对生物利用度研究考察不同的处方、工艺、剂型、规格、给药途径等情况下的暴露量和吸收速率的相似性情况,或结合创新药理化性质和拟开发的目标适应症特点等,不断完善创新药制剂的处方和工艺,为创新药后续开发提供依据。有时需考虑开展绝对生物利用度研究。
创新药关键临床研究前甚至上市前(完成关键临床研究后)改变剂型、改变生产场地或放大生产批量等情况时,需按照相关指导原则要求,充分评估其对制剂性能的影响,根据风险评估结果开展研究,必要时需开展生物等效性研究,以支持与此前完成临床研究数据的可桥接性。具体要求建议参考相关技术指导原则。

根据 ICH E14,FDA,NMPA等相关指导原则要求:所有具有系统生物利用度的非抗心律失常药物,在上市前需进行QT/QTc间期延长以及潜在致心律失常作用的临床研究,考察其对 QT/QTc 间期的影响。
C-QT 研究在药物早期临床试验阶段(如SAD中同步开展)能够获得更宽暴露量范围内的QTc间期数据,有助于早期评估药物心脏安全性风险,为后续临床研究的设计和风险管理提供依据。
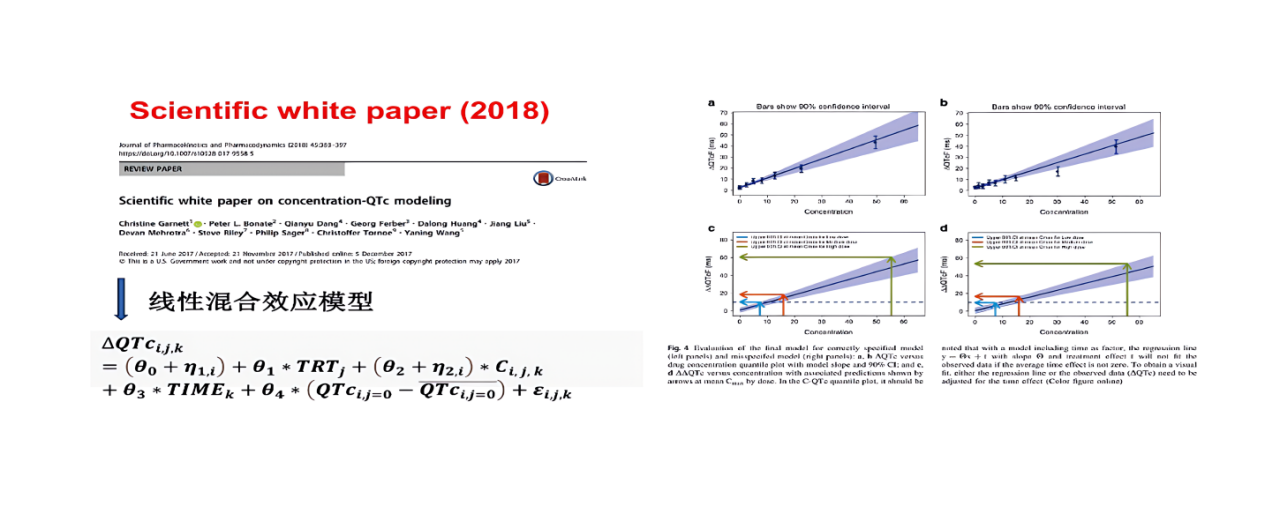

七、总结
科学合理的临床药理学(包括定量药理学)研究有助于深入理解药物在体内的作用过程和机制等,从而提高创新药研发效率和成功率。近些年,创新药临床药理学研究的理念和策略、技术手段和方法等较传统模式发生了改变,不局限于临床药代动力学研究,而是以研究问题为导向,注重将创新药的剂量、暴露量、生物标志物、临床终点(包括有效性和安全性终点)进行量化分析,为后续临床研究的设计提供指导以及为最终的药品说明书推荐用法用量。临床药理学研究应贯穿于创新药上市前和上市后的全生命周期中。
参考文献:
1.《 药物暴露-效应关系研究技术指导原则》
2.《 创新药临床药理学研究技术指导原则》
3.《 化学药创新药临床单次和多次给药剂量递增药代动力学研究技术指导原则》
4.《 抗体类药物临床药理学研究技术指导原则》
5.《肽类药物临床药理学研究技术指导原则》
6.《 模型引导的创新药物剂量探索和优化技术指导原则》
7.《 细胞治疗产品临床药理学研究技术指导原则(试行)》
8.《 放射性标记人体物质平衡研究技术指导原则》
9.《基于药代动力学方法支持用于肿瘤治疗的抗PD-1/PD-L1抗体可选给药方案的技术指导原则》
10.《细胞治疗产品临床药理学研究技术指导原则(试行)》
11.《生物类似药临床药理学研究技术指导原则》
12.《创新药人体生物利用度和生物等效性研究技术指导原则》
13.《化学药创新药临床单次和多次给药剂量递增药代动力学研究技术指导原则》
14.《新药研发过程中食物影响研究技术指导原则》
15.《药物相互作用研究技术指导原则》
16.《肾功能不全患者药代动力学研究技术指导原则》
17.《肝功能损害患者的药代动力学研究技术指导原则》
18.《模型引导的药物研发技术指导原则》
19.《群体药代动力学研究技术指导原则》
20.ICH M4E:TheCommonTechnicalDocumentonEfficacy.2016.
21.ICHE4:Dose-ResponseInformationtoSupportDrugRegistration.1994.
22.ICHE14:TheClinicalEvaluationofQT/QTcIntervalProlongationandProarrhythmicPotentialforNon-AntiarrhythmicDrugs.2005.
23.ICHE14:TheClinicalEvaluationofQT/QTcIntervalProlongationandProarrhythmicPotentialforNon-AntiarrhythmicDrugs.QuestionsandAnswers(R3).2015.
24.临床药理学在创新药研发中的最新进展.CNKI
25.E8:临床试验的一般考虑
26.药物浓度-QTc临床研究技术指导原则(征求意见稿)
27. FDA. Good Review Practice: Clinical Review ofInvestigational New Drug Applications,2013.
28. FDA. Clinical Pharmacology 1: Phase 1 Studies and Early Drug Development, Gerlie Gieser.
29 FDA. Clinical Pharmacology 2: Clinical Pharmacology Considerations During Phase 2 and Phase 3 of DrugDevelopment, Kellie Schoolar Reynolds.
30. FDA In Vitro Drug Interaction Studies -Cytochrome P450 Enzyme- and Transporter-Mediated Drug Interactions,2020.
31. FDA. General Clinical Pharmacology Considerations for Neonatal Studies for Drugs and Biological ProductsGuidance for Industry.2019
32. FDA. Exposure-Response Relationships-Study Design, Data Analysis, and Regulatory Applications,2003.
33.FDA Physiologically Based Pharmacokinetic Analyses -Format and Content 2018.
34.FDA Safety Testing of Drug Metabolites Guidance for Industry,2020
35. ICH, E4: Dose-Response Information to Support Drug Registration . 1994.
36. FDA. Guidance for Industry: Exposure-Response Relationships Study Design, Data Analysis, and RegulatoryApplications.2003.
37. E14 Clinical Evaluation of QT/OTc Interval Prolongation and Proarrhythmic Potential for Non-AntiarrhythmicDrugs,2005.
38. FDA. lmmunogenicity Testing of Therapeutic Protein Products -Developing and Validating Assays for Anti-DrugAntibody Detection Guidance for Industry, 2019.
撰写:李瑷宁
审核:谢珊珊、韩海雄